Ацетилен и его гомологи
Слайды и текст этой презентации
| Слайд №1 |
 |
Ацетилен и
его гомологи. |
| Слайд №2 |
 |
1. СН3 — СН3
2. СН2 = СН2
3. СН ? СН
4. СН2 = СН — СН = СН2
Среди указанных веществ выберите вещество, которое не относится ни к одному из изученных ранее классов углеводородов:
П. Бертло
1860г.
ацетилен |
| Слайд №3 |
 |
|
| Слайд №4 |
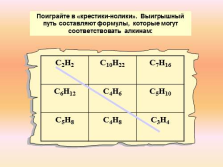 |
Поиграйте в «крестики-нолики». Выигрышный путь составляют формулы, которые могут соответствовать алкинам:
С2Н2 С10Н22
С7Н16
С6Н12
С4Н6
С5Н10
С5Н8
С4Н8
С3Н4
|
| Слайд №5 |
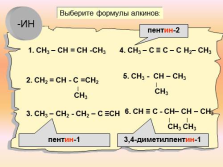 |
1. СН3 – СН = СН -СН3
2. СН2 = СН — С =СН2
?
СН3
3. СН3 – СН2 — СН2 – С ?СН
4. СН3 – С ? С – С Н2– СН3
5. СН3 — СН – СН3
?
СН3
6. СН ? С — СН– СН – СН3
? ?
СН3 СН3
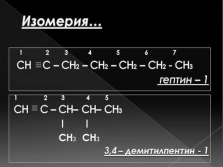
Выберите формулы алкинов:
пентин-2
3,4-диметилпентин-1
пентин-1
-ИН |
| Слайд №6 |
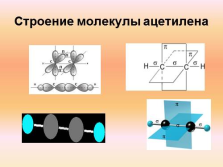 |
Строение молекулы ацетилена |
| Слайд №7 |
 |
|
| Слайд №8 |
 |
|
| Слайд №9 |
 |
|
| Слайд №10 |
 |
|
| Слайд №11 |
 |
Способы получения ацетилена:
эл. ток
1. 2СН4 ? С2Н2 + 3Н2 (метановый способ)
эл. ток
2. 2С + Н2 ? С2Н2
3. СаС2 + 2 Н2О ? Са(ОН)2 + С2 Н2?
(карбидный способ) |
| Слайд №12 |
 |
Химические свойства
РЕАКЦИЯ ГОРЕНИЯ
2СН ? СН + 5О2 ? 4СО2 + 2Н2О |
| Слайд №13 |
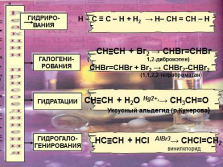 |
Реакции присоединения
ГИДРИРО-
ВАНИЯ
ГАЛОГЕНИ-
РОВАНИЯ
ГИДРАТАЦИИ
ГИДРОГАЛО-
ГЕНИРОВАНИЯ
CH?CH + H2O Hg2+,? CH3CH=O
Уксусный альдегид (р.Кучерова)
СH?CH + Br2 ? CHBr=CHBr
( 1,2-дибромэтен)
CHBr=CHBr + Br2 ? CHBr2-CHBr2
(1,1,2,2-тетрабромэтан)
НC?CH + HСI AlBr3? CНСI=CH2
винилхлорид
R – С ? С – R + Н2 ? R – СН = СН –
Н – С ? С – Н + Н2 ? Н– СН = СН – Н |
| Слайд №14 |
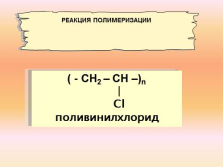 |
( — СН2 – СН –)n
?
Сl
поливинилхлорид
РЕАКЦИЯ ПОЛИМЕРИЗАЦИИ |
| Слайд №15 |
 |
Качественная реакция на алкины с тройной связью в конце цепи:
НC?CH + [Ag(NH3)2]OH ? Аg-C?C-Ag? +2NH3 + H2O
серо-белый осадок
ацетиленид серебра |
| Слайд №16 |
 |
|
| Слайд №17 |
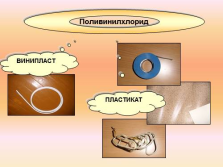 |
Поливинилхлорид
ПЛАСТИКАТ
ВИНИПЛАСТ |
| Слайд №18 |
 |
ПОЛИВИНИЛХЛОРИД
ПОЛИВИНИЛХЛОРИД
Панели ПВХ.
Трубы из ПВХ |
| Слайд №19 |
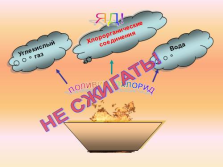 |
ПОЛИВИНИЛХЛОРИД
Углекислый газ
Хлорорганические соединения
Вода
ЯД!
НЕ СЖИГАТЬ! |
| Слайд №20 |
 |
Применение ацетилена для газопламенной обработки металлов испытывает сильную конкуренцию со стороны более доступных горючих газов (природный газ, пропан–бутан и т.д.). Однако, преимущество ацетилена – в самой высокой температуре горения, которая достигает 3100 ° С. Именно поэтому газопламенная обработка ответственных узлов машиностроительных конструкций производится только с помощью ацетилена, который обеспечивает наивысшую производительность и качество процесса сварки. |
| Слайд №21 |
 |
СИНТЕТИЧЕСКИЙ КАУЧУК
Синтетический каучук
Шины из синтетического
каучука
Материал синтетический каучук |
| Слайд №22 |
 |
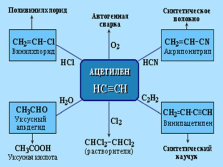
Ацетилен используют для так называемой автогенной сварки и резки металлов. Для этого нужны два баллона с газами — с кислородом (он окрашен в голубой цвет) и с ацетиленом (белого цвета).
Также, ацетилен может служить исходным продуктом для синтеза многих более сложных органических соединений.
Ацетилен — реакционноспособное соединение, вступающее в многочисленные реакции. Химия ацетилена богата. Из него можно получить сотни разнообразных соединений. Недаром из общего объема производства ацетилена примерно 70% используют для промышленного органического синтеза, а 30% — для сварки и резки металлов |
| Слайд №23 |
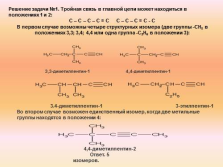 |
3,3-диметилпентин-1 4,4-диметилпентин-1
3.4-диметилпентин-1 3-этилпентин-1
Во втором случае возможен единственный изомер, когда две метильные группы находятся в положении 4:
4,4-диметилпентин-2
Ответ. 5 изомеров.
Решение задачи №1. Тройная связь в главной цепи может находиться в положениях 1 и 2:
С – С – С – С ? С С – С – C ? С — С
В первом случае возможны четыре структурных изомера (две группы -СН3 в положениях 3,3; 3,4; 4,4 или одна группа -С2Н5 в положении 3): |
| Слайд №24 |
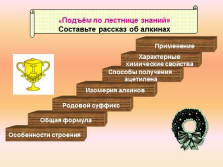 |
«Подъём по лестнице знаний»
Составьте рассказ об алкинах
Особенности строения
Общая формула
Родовой суффикс
Изомерия алкинов
Способы получения
ацетилена
Характерные
химические свойства
Применение |
Оцените статью:
(0 голосов, среднее: 0 из 5)
Поделитесь с друзьями!
Большой сборник презентаций в помощь школьнику.
закрыть
Скопируйте этот код и вставьте его на своем сайте:

