Первый закон термодинамики
Слайды и текст этой презентации
| Слайд №1 |
 |
Учитель физики
ОГКОУ КШИ
“Колпашевский кадетский корпус”
Семин А.А.
Первый закон термодинамики |
| Слайд №2 |
 |
Изучить закон сохранения энергии, распространённый на тепловые явления – первый закон термодинамики.
Рассмотреть изопроцессы в газах с энергетической точки зрения, примененив к ним первый закон термодинамики.
Дать понятие адиабатического процесса.
Цели
|
| Слайд №3 |
 |
Фронтальный опрос
1. Дать определение внутренней энергии.
2.Что называют количеством теплоты?
Повторение
3 .Что называют вечным двигателем первого рода ? |
| Слайд №4 |
 |
Содержание 1-ого закона термодинамики
Применение 1-ого закона термодинамики к изопроцессам в газах
Адиабатический процесс
Необратимость процессов в природе
План урока
|
| Слайд №5 |
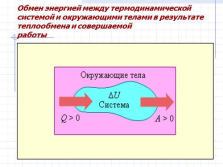 |
Обмен энергией между термодинамической системой и окружающими телами в результате теплообмена и совершаемой
работы |
| Слайд №6 |
 |
Изменение ? U внутренней энергии системы при переходе ее из одного состояния в другое равно сумме работы A внешних сил и количества теплоты Q, переданного системе
Первый закон термодинамики
?U = Q + A |
| Слайд №7 |
 |
Q = ?U + A’
Количество теплоты, полученное системой, идет на изменение ее внутренней энергии и на совершение системой работы над внешними телами.
Вторая запись
первого закона термодинамики
|
| Слайд №8 |
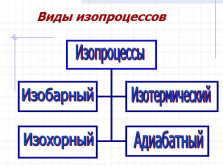 |
Виды изопроцессов
Изопроцессы
Изобарный
Изохорный
Изотермический
Адиабатный |
| Слайд №9 |
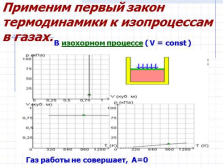 |
Применим первый закон термодинамики к изопроцессам в газах.
В изохорном процессе ( V = const )
Газ работы не совершает, А=0 |
| Слайд №10 |
 |
Здесь U (T1) и U (T2) – внутренние энергии газа в начальном и конечном состояниях.
Q = ?U = U (T2) – U (T1)
Первый закон термодинамики для изохорного процесса |
| Слайд №11 |
 |
Применим первый закон термодинамики к изопроцессам в газах.
В изобарном процессе (p = const) |
| Слайд №12 |
 |
Работа, совершаемая газом, выражается соотношением
A = p (V2 – V1) = p ?V
p-давление
V1,V2- объем в начальном и конечном состояниях соответственно
|
| Слайд №13 |
 |
Применим первый закон термодинамики к изопроцессам в газах.
Первый закон термодинамики для изобарного процесса :
Q = U (T2) – U (T1) + p (V2 – V1) = ?U + p ?V |
| Слайд №14 |
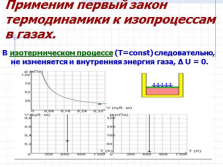 |
Применим первый закон термодинамики к изопроцессам в газах.
В изотермическом процессе (T=const) следовательно, не изменяется и внутренняя энергия газа, ? U = 0. |
| Слайд №15 |
 |
Первый закон термодинамики для изотермического процесса выражается соотношением
Q = A
Количество теплоты Q, полученной газом в процессе изотермического расширения,
превращается в работу над внешними телами. |
| Слайд №16 |
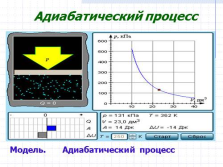 |
Адиабатический процесс
Модель. Адиабатический процесс |
| Слайд №17 |
 |
В адиабатическом процессе Q = 0; поэтому первый закон термодинамики принимает вид
газ совершает работу за счет убыли его внутренней энергии.
A = –?U |
| Слайд №18 |
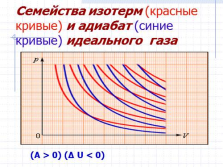 |
Семейства изотерм (красные кривые) и адиабат (синие кривые) идеального газа
(A > 0) (? U < 0) |
| Слайд №19 |
 |
Работа газа в адиабатическом процессе просто выражается через температуры T 1 и T 2 начального и конечного состояний
A = CV (T2 – T1) |
| Слайд №20 |
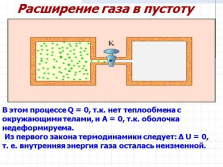 |
Расширение газа в пустоту
В этом процессе Q = 0, т.к. нет теплообмена с окружающими телами, и A = 0, т.к. оболочка недеформируема.
Из первого закона термодинамики следует: ? U = 0, т. е. внутренняя энергия газа осталась неизменной. |
| Слайд №21 |
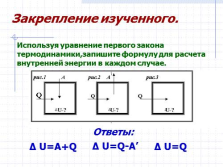 |
? U=A+Q
? U=Q
? U=Q-A’
Используя уравнение первого закона термодинамики,запишите формулу для расчета внутренней энергии в каждом случае.
Закрепление изученного.
Ответы: |
| Слайд №22 |
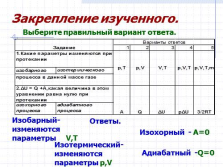 |
Ответы.
Изобарный- изменяются
параметры V,T
Изотермический-изменяются
параметры p,V
Изохорный — A=0
Адиабатный -Q=0
Выберите правильный вариант ответа.
Закрепление изученного. |
| Слайд №23 |
 |
Список использованных источников
1. Г.Я.Мякишев, Б.Б.Буховцев, Н.Н.Сотский «ФИЗИКА 10», Москва, « Просвещение» , 2010 г.
|
Оцените статью:
(3 голоса, среднее: 5 из 5)
Поделитесь с друзьями!
Большой сборник презентаций в помощь школьнику.
закрыть
Скопируйте этот код и вставьте его на своем сайте:

