Альдегиды
Слайды и текст этой презентации
| Слайд №1 |
 |
Альдегиды
Кетоны |
| Слайд №2 |
 |
2
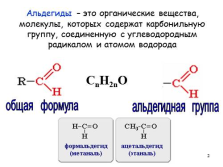
Альдегиды – это органические вещества, молекулы, которых содержат карбонильную группу, соединенную с углеводородным радикалом и атомом водорода
альдегидная группа
общая формула
CnH2nO |
| Слайд №3 |
 |
|
| Слайд №4 |
 |
4
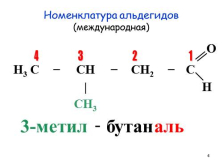
Номенклатура альдегидов(международная)
O
H3 C ? CH ? CH2 ? C
| H
CH3
1
4
3
2
3-метил
—
бутан
аль |
| Слайд №5 |
 |
5
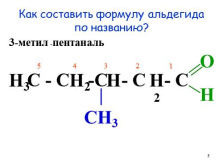
Как составить формулу альдегида по названию?
3-метил
-пентан
аль
С — С -С — С — С
5 4 3 2 1
O
H
|
CH3
H3
H2
H
H2 |
| Слайд №6 |
 |
Названия альдегидов |
| Слайд №7 |
 |
7
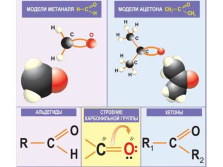
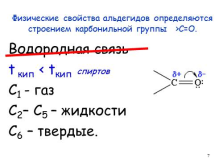
Физические свойства альдегидов определяются строением карбонильной группы >C=O.
Водородная связь
t кип < tкип спиртов
С1 — газ
С2– С5 – жидкости
С6 – твердые.
|
| Слайд №8 |
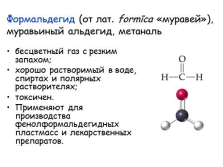 |
Формальдегид (от лат. form?ca «муравей»), муравьиный альдегид, метаналь
бесцветный газ с резким запахом;
хорошо растворимый в воде, спиртах и полярных растворителях;
токсичен.
Применяют для производства фенолформальдегидных пластмасс и лекарственных препаратов. |
| Слайд №9 |
 |
Уксусный альдегид (этаналь, ацетальдегид, метилформальдегид)
Летучая жидкость;
хорошо растворимая в воде;
ядовит;
используется для производства уксусной кислоты, различных пластмасс и ацетатного волокна;
встречается в кофе, в спелых фруктах, хлебе, и синтезируется растениями как результат их метаболизма;
производится окислением этанола. |
| Слайд №10 |
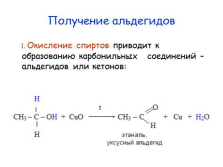 |
Получение альдегидов
1. Окисление спиртов приводит к образованию карбонильных соединений – альдегидов или кетонов: |
| Слайд №11 |
 |
2. Реакция Кучерова
При гидратации ацетилена образуется ацетальдегид,
HC?CH + H2O ? CH3-CHO
Катализаторы реакции Кучерова — соли ртути (Hg2+).
Реакция Кучерова лежит в основе промышленного способа получения ацетальдегида из ацетилена;
открыта русским химиком М. Г. Кучеровым в 1881.
В данный момент почти не применяется из-за вредности катализатора. |
| Слайд №12 |
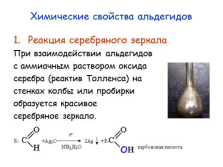 |
Химические свойства альдегидов
Реакция серебряного зеркала
При взаимодействии альдегидов
с аммиачным раствором оксида
серебра (реактив Толленса) на
стенках колбы или пробирки
образуется красивое
серебряное зеркало. |
| Слайд №13 |
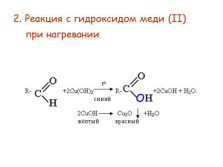 |
2. Реакция с гидроксидом меди (II) при нагревании |
| Слайд №14 |
 |
3. Гидрирование
По месту двойной связи в ней могут проходить реакции присоединения.
Присоединение водорода осуществляется в присутствии катализаторов (Ni, Co, Pd и др.) и приводит к образованию первичных спиртов.
O II R – C + H2 R – CH2 – OH (первичный спирт) I H
Ni, t |
| Слайд №15 |
 |
|
| Слайд №16 |
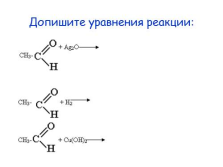 |
Допишите уравнения реакции: |
| Слайд №17 |
 |
Интернет-ресурсы:
http://enprophil.ucoz.ru/_nw/3/84251351.jpg
|
Оцените статью:
(0 голосов, среднее: 0 из 5)
Поделитесь с друзьями!
Большой сборник презентаций в помощь школьнику.
закрыть
Скопируйте этот код и вставьте его на своем сайте:

