Анилин и его применение
Слайды и текст этой презентации
| Слайд №1 |
 |
Анилин
Выполнил ученик 10 класса: Бомбин Андрей |
| Слайд №2 |
 |
История создания
В 1840 Ю.Ф.Фрицше обнаружил, что при нагревании с щелочью синяя окраска индиго исчезает и образуется вязкая масса коричневого цвета. Очистив это в-во, Фрицше получил быстро желтеющую на воздухе маслянистую жидкость и назвал её анилином.
Примерно в то же время О.Унфердорбен нагреванием кристаллического индиго получил продукт, который он назвал кристаллином.
Фридлиб Фердинанд Рунге в продуктах перегонки каменноугольной смолы открыл вещество, названное им кианолом.
Н.Н.Зинин в 1841 году открыл способ восстановления нитробензола до соответствующего ароматического амина – бензидама.
1843 г. – Гофман установил, что бензидам, кианол, кристаллин и анилин – одно и то же соединение. Остановились на анилине.
|
| Слайд №3 |
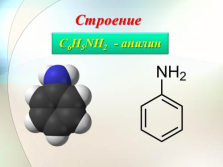 |
Строение
C6H5NH2 — анилин
|
| Слайд №4 |
 |
Физические свойства
Анилин — бесцветная маслянистая жидкость.
Немного тяжелее воды, малорастворим в ней.
Хорошо растворяется в этаноле и бензоле.
При окислении на воздухе становится светло-коричневого цвета.
Температура кипения – 174 С.
Проявляет слабые основные свойства.
Ядовит.
|
| Слайд №5 |
 |
В промышленности анилин получают в две стадии. На первой стадии бензол нитруется смесью концентрированной азотной и серной кислот при температуре 50 — 60°C в результате образуется нитробензол. На втором этапе нитробензол гидрируют при температуре 200-300°C в присутствии катализаторов.
Получение
C6H5NO2 + 3Н2 ? C6H5NH2 + 2Н2О. |
| Слайд №6 |
 |
Другим способом получение анилина является восстановление нитро соединений-
Реакция Зинина:
C6H5NO2 + 3(NH4)2S ? C6H5NH2 +
6NH3 + 3S + 2H2O |
| Слайд №7 |
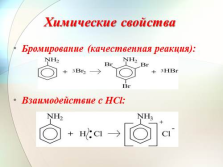 |
Химические свойства
Бромирование (качественная реакция):
Взаимодействие с HCl:
|
| Слайд №8 |
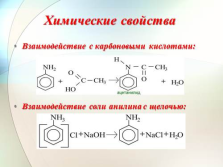 |
Химические свойства
Взаимодействие с карбоновыми кислотами:
Взаимодействие соли анилина с щелочью:
|
| Слайд №9 |
 |
Анилин+соляная кислота |
| Слайд №10 |
 |
Окисление анилина раствором хлорной извести |
| Слайд №11 |
 |
Применение
В настоящий момент в мире основная часть (85%) производимого анилина используется для производства метилдиизоционатов (MDI), используемых затем для производства полиуретанов. Анилин также используется при производстве искусственных каучуков (9%), гербицидов (2%) и красителей (2%).
В России он в основном применяется в качестве полупродукта в производстве красителей, взрывчатых веществ и лекарственных средств (сульфаниламидные препараты).
|
| Слайд №12 |
 |
Спасибо за внимание! |
Оцените статью:
(1 голос, среднее: 5 из 5)
Поделитесь с друзьями!
Большой сборник презентаций в помощь школьнику.
закрыть
Скопируйте этот код и вставьте его на своем сайте:

