Химия и здоровье человека
Слайды и текст этой презентации
Целью работы школьного коллектива может быть только
охрана и сохранение здоровья,
мотивация участников образовательного процесса на здоровый образ жизни.
на уроках химииЗадачи учителя:
Помочь ученику сохранить свое здоровье
Помочь приобрести знания об основах здорового образа жизни
Вызвать интерес к самопознанию и самосовершенствованию
Уроки здоровья «Питание и здоровье», о наркотических веществах, о табаке и курении; повторно-обобщающие уроки
Частичное введение некоторых вопросов в содержание урока – значение изучаемых в теме веществ для организма человека, правила обращения с веществами
Введение материала в содержание расчетных задач
Факультативные занятия и кружковая работа.
ручка, стекло, стакан, олово, карандаш, тарелка, керамика, очки, ртуть, алюминий, тальк.
Составив слово из первых букв веществ, вы узнаете, кто является автором строк «Здоровье – это не все, но все без здоровья ничто»,
Ответ:
Стекло, Олово, Керамика, Ртуть, Алюминий, Тальк
Из первых букв названий вы узнаете фрукт, который рекомендуют для профилактики агрессивных проявлений;
Ответ: Банан.
но его лучше не есть натощак, так как это способствуют образованию газов. Оказывается, у замороженного фрукта вкус такой же, как и у ванильного мороженного, он не менее сладок, а калорий и жира в нем значительно меньше.
Ответ вам подскажет суточную потребность организма в меди (в миллиграммах).
Медь участвует в синтезе гемоглобина и
определяет антиоксидантный потенциал
сыворотки крови.
Решение:
n (Cu) = 31• 10²³ / 6,02 • 10²³ = 5 (моль)
Ответ: 5мг
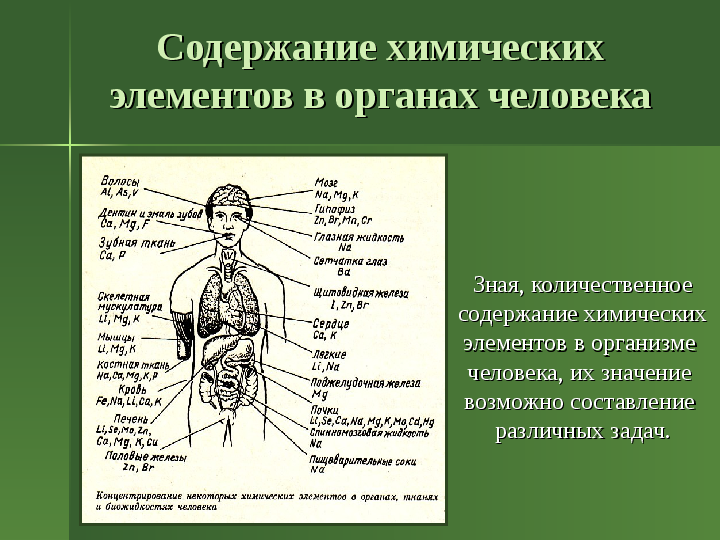
содержание химических
элементов в организме
человека, их значение
возможно составление
различных задач.
Вычислив, вы узнаете,
сколько минут жизни забирает
одна выкуренная сигарета.
Решение:
Vm (CO2) = 22,4 моль/л
n (CO2) = 134,4 / 22,4 = 6 (моль).
Ответ: Одна выкуренная сигарета
отнимает 6 мин. жизни.
Нормальный уровень шума составляет величину, равную массе 0,2 моль сульфида алюминия.
Решение: М (Al2S3)= 150 г/ моль
Масса 0,2 моль Al2S3 = 30 г.
Ответ: Величина шума, вызывающая глухоту равна 150 дБ. Нормальный уровень шума – 30 дБ. Громкость звука музыкальных усилителей на дискотеках 110 дБ
а) вода массой 162 грамма,
б) вода массой 180 граммов.
Полученные ответы подскажут вам, какое количество часов для сна необходимо школьнику среднего звена, чтоб полноценно отдохнуть.
Ответ : продолжительность сна учащихся среднего звена 9-10 часов, старшеклассников не менее 8,5 часов
а) оксид кальция массой 5,6г
б) оксид калия массой — 4,7 г
в) оксид серы (IV) массой – 16 г
г) оксид серы (VI) массой- 5,12г
д) оксид цинка – 81г
Ответ вам подскажет, сколько мг витаминов содержится в 100г молока.
Решение :
а) витамина А -0,10 мг б) витамина В1- 0,05 мг
в) витамина В2 – 0,17 мг г ) витамина РР – 0,08 мг
д) витамина С -1,00 мг
Ответы задачи соответствуют цифрам заболеваний:
0,2 – грипп, насморк; 0, 52 – язвенная болезнь, энурез; 0,13 – слабоумие, галлюцинации; 0,48 – плоскостопие; 0,35 — импотенция
Решение:
M (C2H6O) = 24 + 6 + 16 = 46
ω (С) = 24 / 46 = 0,52
ω (Н) = 6 / 46 = 0,13
ω (О) = 16 / 46 = 0,35
У одноатомных спиртов с увеличением числа атомов углерода в молекуле нарастает их гемолитическое действие (гемолиз — разрушение эритроцитов крови с выделением гемоглобина во внешнюю среду). Спирты – гемолитические яды (как, например, змеиные яды)
а) стимулируют обмен веществ в мозге и этим облегчают процесс заучивания
карбонат натрия и соляная кислота:
1-морковь; 2- ананас; 3- горох; 4 – хлеб
б) облегчают восприятие информации и восстанавливают силы
алюминий с раствором серной кислоты:
1- помидор; 2- лимон; 3- грейпфрут; 4 – сосиски
в) нейтрализуют отрицательные эмоции:
железо с хлором:
1- огурец; 2- банан; 3- клубника; 4 — яблоко
Ответ: а) морковь и ананас ( Na2CO3 + 2 HCl →);
б) лимон – облегчает восприятие информации, грейпфрут восстанавливает силы (2Al + 3 H2SO4 →);
в) банан и клубника (2Fe + 3 Cl2 →)
1. Окисление алюминия
красный: 1-грусть, 2-спокойствие, 3-активность и раздражительность,
4 – собранность
2. Взаимодействие цинка с соляной кислотой
желтый – 1 рассеянность, 2-активность и оптимизм, 3-пассивность и слабость,
4 – тоска
3. Взаимодействие железа с хлором
зеленый- 1- возбуждение, 2 -агрессивность, 3- спокойствие, 4 – утомление
4. Горение серы
синий – 1- агрессивность, 2- открытость, 3- раздражительность, 4 – нежность
Ответ:
1. Аl – 3e → Al+3 красный: 3 – активность и раздражительность
2. Zn – 2e → Zn+2 желтый: 2 — активность и оптимизм
3. Fe – 3e → Fe+3 зеленый: 3 — спокойствие
4. S – 4e → S+4 синий: 4 — нежность
По мнению ученых, цвет и интерьер комнаты отражают привычки человека, во многом определяя его настроение и самочувствие. Выбирая цветовую гамму комнаты, надо принимать во внимание и ее освещенность. Достаточная освещенность снимает утомление.
а) окисления фосфора (V)
б) горения аммиака в отсутствии катализатора
в) окисления аммиака в присутствии платинового катализатора
г) разложения нитрата железа(III)
уравняйте,
сложите коэффициенты в уравнениях химических реакции и вы узнаете:
а) в какое время у человека наивысшая работоспособность.
б) в какое время у человека наибольшее утомление
в) в какое время у человека вечерний подъем работоспособности
г) когда необходимо прекращать всякую деятельность
Использование полученных знаний о биологических ритмах при составлении режима дня позволит достичь максимальной работоспособности и повысить сопротивляемость организма к утомлению.
Ответ: а) 4Р + 5О2 = 2 Р2О5 (11часов)
б) 4NH3 + 3O2 = 2N2 + 6H2O (15 часов)
в) 4NH3 + 5O2 = 4NO + 6H2O (19 часов)
г) 4Fe (NO3)3 = 2 Fe2O3 + 12 NO2 + 3 O2 ( 21 час)
контрастное средство, но в нем недопустима примесь карбоната
бария. Известны случаи отравления , если в сульфате бария
присутствовала примесь карбоната бария. Объясните причину
отравления и как его избежать.
Решение:
Сульфат бария считается безвредным, так как он не растворим в воде. Но ион бария очень токсичен, Если в сульфате бария присутствует примесь карбоната бария, то, попав в кислотную среду желудка, ион бария будет переходить в раствор:
BaCO3 + 2HCl = BaCl2 + CO2 + H2O
BaCO3 + 2Н+ = Ba²+ + CO2 + H2O
Для избавления от примесей возможно приготовление суспензии не в дистиллированной воде, а в сульфатных растворах, например, в растворе сульфата натрия. То есть, необходимо перевести все примеси соединений бария в нерастворимый сульфат.
Решение:
Хлорид бария – растворимая соль, она будет в виде ионов, а сульфат бария в виде суспензии возможно «уловить» рентгеновским аппаратом.
H2SO4 + BaCl2 = 2НCl + Ba SO4↓
n (Ba SO4) = 100/233 = 0,429 (моль)
n (H2SO4) = 0, 429 моль по уравнению.
m (H2SO4 ) = 0,429 • 98 = 42 (г)
m р-ра (H2SO4) = 42 • 0,49 = 20,6 (г)
Рассчитайте, в какой массе раствора глюкозы с массовой долей 5 % следует растворить 120г ее, чтобы получить раствор с массовой долей глюкозы 8 %.
Решение:
Пусть масса 5% раствора – х, тогда
0,05х + 120 = 0,08х + 120 · 0,08
110,4 = 0,03х
х = 3680
необходимо 3680 г 5% раствора.
Объясните с химической точки зрения это явление.
Решение: хлор тяжелее воздуха DвCl2= 71/29 =2,45
гидрокарбонат натрия – соль, образованная слабой кислотой и сильным основанием, идет гидролиз по аниону – среда щелочная, хлор нейтрализуется
Сl2 + 2NaOH = NaCl + NaClO + H2O
В случае загрязнения атмосферы аммиаком, надеть марлевые повязки, смоченные 3% раствором уксусной кислоты и располагаться на первых этажах.
Объясните с химической точки зрения это явление.
Решение: аммиак легче воздуха
Dв NH3 = 17/29 = 0,59
аммиак обладает основными свойствами и нейтрализуется уксусной кислотой:
NH3 + CH3COOH = CH3COONH4
ртути является обработка загрязненного места
йодной настойкой. Какую массу йодной настойки,
содержащей 5% йода, нужно использовать для
уничтожения 2г ртути.
Решение:
2Hg + I2 = Hg2I2
n(Hg)/2=n(I2)/1
n (Hg) = m (Hg) / M (Hg)
n(I2) = m (I2) / M (I2) = ω (I2) х m (р-ра)/ M (I2)
m (р — ра) = m (Hg) х M (I2) / {2 M (Hg) ω (I2) }
m (р — ра) = 2.254./ {2.201/0,05}= 25,3 (г)
Почему для зубов особенно опасна углеводная пища
(белый хлеб, печенье, сахар)?
Ответ: многочисленные бактерии, находящиеся во рту, потребляют из пищи сахар. В ходе их жизнедеятельности при разложении углеводов образуется молочная кислота, которая повышает кислотность слюны, что разрушающе действует на эмаль и твердые ткани зубов.
Чем больше во рту сахара, тем вероятнее развитие кариеса!!!
становятся очень чувствительны к горячей и
холодной пище, но эти ощущения проходят, если два
раза в день чистить зубы пастой, содержащей фтор.
Как с химической точки зрения объяснить этот факт?.
Ответ:
Соединения фтора переводят Ca5OH(PO4)3 в CaF2 , а он, в свою очередь, адсорбируется на эмали, предохраняя ее от воздействия кислот, образующихся при разложении пищи. Также фторидные соединения подавляют жизнедеятельность бактерий, эмаль не разрушается и становится не чувствительной к горячей и холодной пище.
Запишите уравнения химической реакции. Возможно ли с помощью питьевой соды навсегда избавиться от «изжоги». Почему?
Ответ:
NaHCO3 + HCl = NaCl + CO2 + H2O
C помощью питьевой соды нельзя навсегда избавиться от «изжоги» так как временная нейтрализация кислоты ведет к дальнейшему увеличению ее образования:
CO2 + H2O + Cl¯ → HCl + HCO3¯
медицине в виде 5% раствора для смазывания обожженных мест и как кровоостанавливающее
средство. Определить массу перманганата калия и
воды, необходимых для приготовления 50 г данного раствора.
Более слабые растворы употребляются для полоскания рта и горла как дезинфицирующее средство вследствие его высокой окислительной способности.
Решение:
m(KMnO4) = 50 • 0,05 = 2,5 9 (г).
m(H2O) = 50 – 2,5 = 47,5 (г)
Запишите уравнения химических реакций и условия их проведения:
Решение:
2KMnO4 = K2MnO4 + MnO2 + O2
2H2O2 = 2H2O + O2
(tº выше 150º или медленное разложение при
комнатной температуре)
Решение:
2KMnO4 + 3С2 Н5ОН = 2MnO2 + С Н3СНО + 2КОН + 2H2O (20-30º) 2KMnO4 + 2(NH3 • H2O) конц. = 2MnO2 + N2 + 2KOH + H2O
MnO2 + СН3СНО + КОН + H2O
MnO2 + N2 + KOH + H2O
нашатырного спирта
питьевой соды
этилового спирта.
Ответ мотивируйте.
Ответ:
Раствор аммиака – щелочь, раствор гидрокарбоната натрия имеет щелочную среду, поэтому, фенолфталеин приобретает малиновую окраску:
HCO3- + H2O = H2CO3 + OH-
при закреплении нового материала
как дополнительное задание во время контрольной работы
как творческое задание по самостоятельному составлению задач
или предложить подобрать к математическим расчетам материал по здоровьесбережению
для составления задач:Присутствие химических элементов в организме человека, в каких органах они находятся, их роль, токсичность, источники, суточная норма
О роли некоторых веществ (вода, серебро, витамины)
Применение неорганических веществ как лекарственных препаратов
О химических явлениях в организме человека (буферные системы, электрохимические явления, явления диффузии и осмоса)
Химия и гигиена
О пище и пищевых продуктах
Знаете ли вы, что…