Кремний и его соединения
Слайды и текст этой презентации
| Слайд №1 |
 |
Кремний и его соединения
ГОУ СОШ № 661
УЧИТЕЛЬ ХИМИИ
Ефремова С.А. |
| Слайд №2 |
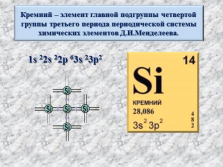 |
Кремний – элемент главной подгруппы четвертой группы третьего периода периодической системы химических элементов Д.И.Менделеева.
1s 22s 22p 63s 23p2 |
| Слайд №3 |
 |
Историческая справка
Чистый элементарный кремний был получен шведским химиком Йенсом Якобом Берцелиусом в 1825 году действием металлического калия на фтористый кремний SiF4
Русское название «кремний» введено в 1834 году российским химиком Германом Ивановичем Гессом. В переводе с древнегреческого ??????? — «утес, гора». |
| Слайд №4 |
 |
Нахождение в природе
Кремний – второй по распространенности после кислорода химический элемент. Земная кора более чем на четверть состоит из его соединений. В природе кремний встречается только в виде диоксидов (кремнезёма) и солей кремниевой кислоты (силикатов). Наиболее широко распространены алюмосиликаты.
Полевой шпат
Кварц
Слюда
K2O*Al2O3*SiO2
Кварц
SiO2
K2O*Al2O3*6SiO2*H2O |
| Слайд №5 |
 |
Физические свойства
Аморфный кремний
Кристаллический кремний
Образуется путем прокаливания с магнием мелкого белого песка.
Мелкий порошок бурого цвета.
Плотность – 2,0 г/см?
Температура плавления – 1400?С.
Получается путем направленной кристаллизации расплава в тигле, а также методом зонной плавки.
Твердое вещество темно-серого цвета со слабым металлическим блеском.
Полупроводник. |
| Слайд №6 |
 |
Химические свойства
Горит в кислороде, образуя диоксид кремния:
При нагревании соединяется с металлами с образованием силицидов:
Взаимодействует со щелочами, образуя силикаты и водород:
Силан на воздухе самовоспламеняется и сгорает с образованием диоксида кремния и воды:
Силициды разлагаются водой или кислотами, при этом выделяется газообразное водородное соединение кремния – силан:
Si + 2 NaOH + H2O?
? Na2SiO3 + 2H2?
SiH4 + 2O2 = SiO2 + 2H2O
Mg2Si + 2H2SO4 ? 2MgSO4 + SiH4?
t
Si + O2 ? SiO2
t
Si + 2Mg ? Mg2Si |
| Слайд №7 |
 |
Получение кремния
Кремний получают, восстанавливая его из оксида кремния (IV) магнием или углеродом:
t
SiO2 + 2Mg = 2MgO + Si,
t
SiO2 + 2C = Si + 2CO?.
|
| Слайд №8 |
 |
Радуга кремнезёма
Опал
Агат
Аметист
Яшма
Халцедон
Агат
Сердолик |
| Слайд №9 |
 |
Радуга кремнезёма
Оксид кремния (IV), или кремнезем SiO2 , как и CO2, является кислотным оксидом. Однако, он имеет не молекулярную, а кристаллическую решетку.
Физические свойства:
Твердое и тугоплавкое вещество. Не растворяется в воде и кислотах (кроме плавиковой). Взаимодействует при высоких температурах со щелочами с образованием солей кремниевой кислоты – силикатов.
Химические свойства:
t
SiO2 + 2NaOH = Na2SiO3 + H2O
t
SiO2 + CaO = CaSiO3
t
SiO2 + CaCO3 = CaSiO3 + CO2? |
| Слайд №10 |
 |
Применение кремния
Si |
| Слайд №11 |
 |
Применение кремния
SiО2 |
| Слайд №12 |
 |
Использованные источники
О.С.Габриелян. Химия. 9 класс. Базовый уровень. М. Дрофа. 2013.
Г.Е.Рудзитис, Ф.Г.Фельдман. Химия. 9 класс. М. Просвещение. 2012.
Поурочные планы по учебнику «Химия. 9 класс» О.С.Габриеляна. Составитель С.В.Бочарова. Волгоград. 2007.
Портрет Й.Я.Берцелиуса
http://allchem.ru/images/biography/Berzelius.jpg
5. Портрет Г.И.Гесса
http://www.top4man.ru/upload/mineral-water-2.jpg
|
Оцените статью:
(1 голос, среднее: 4 из 5)
Поделитесь с друзьями!
Большой сборник презентаций в помощь школьнику.
закрыть
Скопируйте этот код и вставьте его на своем сайте:

