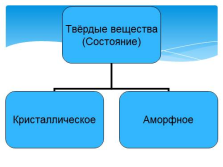
| Слайд №2 |
 |
1)познакомить учащихся с понятием аморфные вещества и кристаллические решетки;
2)дать понятие о типах кристаллических решеток
3)рассмотреть свойства веществ в зависимости от типа кристаллических решеток;
4)развивать познавательный интерес при выполнении теоретических и практических заданий.
Задачи урока: |
| Слайд №3 |
 |
|
| Слайд №4 |
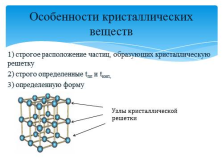 |
1) строгое расположение частиц, образующих кристаллическую решетку
2) строго определенные tпл и tкип,
3) определенную форму
Особенности кристаллических веществ
Узлы кристаллической
решетки |
| Слайд №5 |
 |
Формы кристаллов
Кристаллы поваренной соли имеют форму куба, калийной селитры — форму призмы, алюминиевых квасцов — форму октаэдров и т. д.
Кристаллы природной поваренной соли
Кубическая форма кристаллов
поваренной соли |
| Слайд №6 |
 |
Некоторые вещества могут находиться и в кристаллическом, и в аморфном состояниях, — например сера, оксид кремния ( IV ) и др.
Сера
Вещества могут быть переведены из аморфного состояния в кристаллическое и наоборот. |
| Слайд №7 |
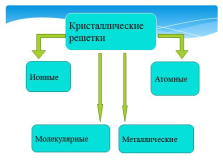 |
Кристаллические
решетки
Металлические
Молекулярные
Атомные
Ионные |
| Слайд №8 |
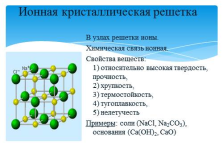 |
Ионная кристаллическая решетка
В узлах решетки ионы.
Химическая связь ионная.
Свойства веществ: 1) относительно высокая твердость, прочность, 2) хрупкость, 3) термостойкость, 4) тугоплавкость, 5) нелетучесть
Примеры: соли (NaCl, Na2CO3), основания (Ca(OH)2, CaO) |
| Слайд №9 |
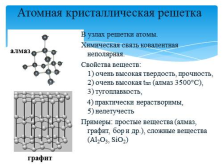 |
Атомная кристаллическая решетка
В узлах решетки атомы.
Химическая связь ковалентная неполярная.
Свойства веществ: 1) очень высокая твердость, прочность, 2) очень высокая tпл (алмаз 3500°С),3) тугоплавкость,
4) практически нерастворимы, 5) нелетучесть
Примеры: простые вещества (алмаз, графит, бор и др.), сложные вещества (Al2O3, SiO2)
алмаз
графит |
| Слайд №10 |
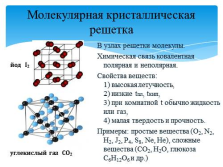 |
Молекулярная кристаллическая решетка
В узлах решетки молекулы.
Химическая связь ковалентная полярная и неполярная.
Свойства веществ: 1) высокая летучность, 2) низкие tпл, tкип, 3) при комнатной t обычно жидкость или газ, 4) малая твердость и прочность.
Примеры: простые вещества (O2, N2, H2, J2, P4, S8, Ne, He), сложные вещества (СО2, H2O, глюкоза С6H12O6 и др.)
йод I2
углекислый газ СО2 |
| Слайд №11 |
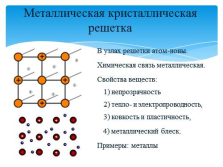 |
Металлическая кристаллическая решетка
В узлах решетки атом-ионы.
Химическая связь металлическая.
Свойства веществ: 1) непрозрачность2) тепло- и электропроводность,3) ковкость и пластичность,
4) металлический блеск.
Примеры: металлы |
| Слайд №12 |
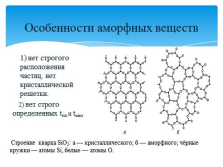 |
Особенности аморфных веществ
1) нет строгого расположения частиц, нет кристаллической решетки.
2) нет строго определенных tпл и tкип
Строение кварца SiO2: а — кристаллического; б — аморфного; чёрные кружки — атомы Si, белые — атомы O. |
| Слайд №13 |
 |
В аморфном состоянии могут находиться не только вещества, состоящие из отдельных атомов и обычных молекул, как стекла и жидкости (низкомолекулярные соединения), но и вещества, состоящие из длинноцепочечных макромолекул — высокомолекулярные соединения, или полимеры.
Примеры аморфных веществ: стекла, смолы, воск, шоколад, янтарь |
| Слайд №14 |
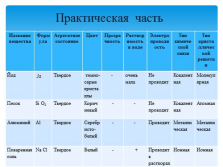 |
Практическая часть
Название вещества Формула Агрегатное состояние Цвет Прозрачность Растворимость в воде Электропроводность Тип химической связи Тип кристаллической решетки
Йод J2 Твердое темно-серые кристаллы — очень мала Не проводит Ковалентная Молекулярная
Песок Si O2 Твердое Коричневый — — Не проводит Ковалентная Атомная
Алюминий Al Твердое Серебристо-белый — — Проводит Металлическая Металлическая
Поваренная соль Na Cl Твердое Белый — + Проводит в растворах Ионная Ионная |
| Слайд №15 |
 |
1.В узлах разных кристаллических решеток могут находиться
а)атомы б)электроны в)протоны
г)ионы д)молекулы
2.Выберите вещества, имеющие атомную кристаллическую решетку.
а)графит в)алмаз
б)сульфат меди г)оксид кремния
3.Выберите вещества, имеющие ионную кристаллическую решетку:
а)оксид кремния б)хлорид натрия в)гидроксид калия г)сульфат алюминия
4.Атомная кристаллическая решётка характерна для:
a) алюминия и графита б) серы и йода
в) оксида кремния и хлорида натрия г) алмаза и бора
Обобщение темыТест «Проверь себя»: |
| Слайд №16 |
 |
Список источников
1) Габриелян О.С. Химия. 8 класс: учеб. для общеобразоват. учрежд. / О.С. Габриелян. – 16 изд., стереотип. – М.: Дрофа, 2010.-270 с., [2]с.: ил.
Использованы изображения: 2)http://inetshpora.wordpress.com/himiya/kristallicheskie-reshetki/ — интернет-шпаргалки
3)http://nsportal.ru/sites/default/files/2013/2/test_kristalicheskie reshyotki.docx- тест «Проверь себя»
4) http://mirmineralov.ru/fotografii-/81.html -кристаллы природной поваренной соли
5) http://www.webois.org.ua/jewellery/stones-katalog/mineral-galit.htm минерал галит (поваренная соль)
6) http://xn--80ajiobhw4g.xn--p1ai/topic/298- сера |

