Углерод
Слайды и текст этой презентации
| Слайд №1 |
 |
Урок по теме «Углерод»
Урок
на тему «Углерод» |
| Слайд №2 |
 |
«Область соединений углерода так велика, что составляет особую отрасль химии, т.е. химии углеродистых или, лучше, углеводородистых соединений».
Д.И.Менделеев |
| Слайд №3 |
 |
Положение в периодической системе
4 группа
Главная подгруппа
2 период
Состав атома:
6 протонов, 6 электронов, 6 нейтронов
Неметалл
Р — элемент |
| Слайд №4 |
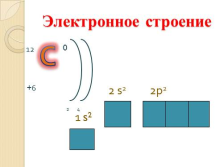 |
1 s2
2 s2
2p2
Электронное строение |
| Слайд №5 |
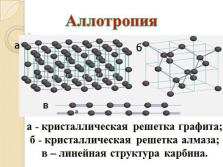 |
а
б
в
а — кристаллическая решетка графита;
б — кристаллическая решетка алмаза;
в – линейная структура карбина.
Аллотропия
а |
| Слайд №6 |
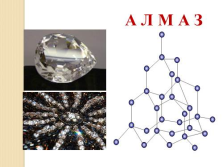 |
А Л М А З |
| Слайд №7 |
 |
Звезда ордена
Св. Андрея Первозванного
Алмаз «Шах»
Скипетр
императорский |
| Слайд №8 |
 |
Большая
императорская корона
Малая
императорская корона |
| Слайд №9 |
 |
Г Р А Ф И Т
Применение графита:
Электроды для электролиза
Облицовка сопел ракетных двигателей
Смазка для трущихся поверхностей, работающих при очень высоких и очень низких температурах
Стержни для карандашей
Замедлители нейтронов в ядерных реакторах |
| Слайд №10 |
 |
Сходное с графитом
строение имеют:
Сажа
Древесный
уголь
Кокс
типографская краска, картриджи, резина, косметическая тушь
восстановитель при
выплавке чугуна из руд
твердое топливо, адсорбент для очистки газов и жидкостей |
| Слайд №11 |
 |
Карбин обладает полупроводниковыми свойствами, причём под воздействием света его проводимость сильно увеличивается. На этом свойстве основано первое практическое применение — в фотоэлементах.
КАРБИН |
| Слайд №12 |
 |
Карбин широко использоваться в различных областях, включая микроэлектронику на моноуглеродной основе, термоядерный синтез, технологии получения чистых алмазов без металлических примесей. |
| Слайд №13 |
 |
Карбин уже нашел применение в электронике, космонавтике, авиации и медицине. Перспективно его применение в оптике, микроволновой и электрической технологиях, в конструкциях источников тока и пр. Во всех этих областях ключевое значение имеет высокая стабильность материала. |
| Слайд №14 |
 |
1) Углерод – окислитель:
а) С + Н2
б) С + Al
2) Углерод – восстановитель:
а) С + О2
б) С + О2
в) С + Н2О
г) С + Fe2O3
условия
Химические свойства |
| Слайд №15 |
 |
С
сталь
сельское хозяйство
топливо
медицина
типография
ювелирные изделия
адсорбент
резина
крем обуви
Применение
|
| Слайд №16 |
 |
Самостоятельная работа
Составить схемы электронного баланса следующих реакций:
Ca + 2C = CaC2
4A1 + 3C = A14C3
C + 2FeO = 2Fe + CO2
|
| Слайд №17 |
 |
Какое значение имеют для тебя знания и умения, полученные на уроке?
Не очень важны
Важные
Очень важны
|
| Слайд №18 |
 |
Как ты оцениваешь полученные сегодня знания?
Не осознанные
Осознанные
Глубокие
|
| Слайд №19 |
 |
С каким настроением ты изучал этот материал?
Не интересно вообще
Не очень интересно
Было интересно |
| Слайд №20 |
 |
Как оцениваешь свою деятельность?
Удовлетворительно
Хорошо
Отлично
|
| Слайд №21 |
 |
Как оцениваешь деятельность партнёра?
Удовлетворительно
Хорошо
Отлично
|
| Слайд №22 |
 |
Домашнее задание
§ 29 упр 8
СОСТАВИТЬ ТАБЛИЦУ ПО СРАВНЕНИЮ СВОЙСТВ АЛМАЗА И ГРАФИТА.
|
Оцените статью:
(0 голосов, среднее: 0 из 5)
Поделитесь с друзьями!
Большой сборник презентаций в помощь школьнику.
закрыть
Скопируйте этот код и вставьте его на своем сайте:

