Углеводороды — Алканы
Слайды и текст этой презентации
| Слайд №1 |
 |
Углеводороды. Алканы
ГБОУ СОШ № 661
Санкт-Петербург
Учитель химии
Ефремова С.А. |
| Слайд №2 |
 |
Углеводороды – органические соединения, состоящие исключительно из атомов углерода и водорода. Углеводороды считаются базовыми соединениями органической химии, все остальные органические соединения рассматриваются как их производные.
Поскольку углерод имеет четыре валентных электрона, а водород – один, простейший углеводород (природный газ) – метан (СН4) |
| Слайд №3 |
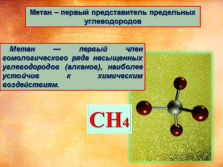 |
Метан – первый представитель предельных углеводородов
Метан — первый член гомологического ряда насыщенных углеводородов (алканов), наиболее устойчив к химическим воздействиям. |
| Слайд №4 |
 |
Алканы
Метан, этан, пропан, бутан являются первыми четырьмя членами гомологического ряда предельных углеводородов – алканов.
Алканы –
это предельные углеводороды, в молекулах которых все атомы связаны одинарными связями. Состав их отражает общая формула
Cn + H2n + 2 |
| Слайд №5 |
 |
Молекулярная форма метана:
– электронная формула (ковалентная полярная связь);
– структурная формула (порядок соединения атомов в молекуле)
.
Но:
Строение молекулы метана |
| Слайд №6 |
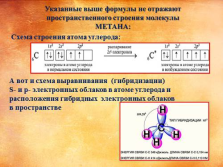 |
Схема строения атома углерода:
А вот и схема выравнивания (гибридизации)
S- и p- электронных облаков в атоме углерода и
расположения гибридных электронных облаков
в пространстве
|
| Слайд №7 |
 |
Природный газ
Добыча
Хранение
Переработка |
| Слайд №8 |
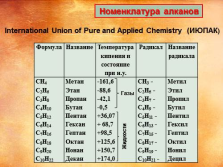 |
Номенклатура алканов
Формула Название Температура кипения и состояние при н.у. Радикал Название радикала
CH4
C2H6
C3H8
C4H10
C5H12
C6H14
C7H16
C8H18
C9H20
C10H22 Метан
Этан
Пропан
Бутан
Пентан
Гексан
Гептан
Октан
Нонан
Декан -161,6
-88,6
-42,1
-0,5
+36,07
+ 68,7
+98,5
+125,6
+150,7
+174,0 CH3 —
C2H5 —
C3H7 —
C4H9 —
C5H11 —
C6H13 —
C7H15 —
C8H17 —
C9H19 —
C10H21 — Метил
Этил
Пропил
Бутил
Пентил
Гексил
Гептил
Октил
Нонил
Децил
Газы
Жидкости
International Union of Pure and Applied Chemistry (ИЮПАК) |
| Слайд №9 |
 |
Номенклатура алканов
Для определения названия углеводорода следует придерживаться следующего порядка:
1. Выбрать в формуле наиболее длинную углеродную цепь и символы атомов углерода в ней пронумеровать, начиная с того конца цепи, к которому ближе разветвление:
CH3
4 3 2? 1
CH3 ? CH2 ? C ? CH3
?
CH3
2. Назвать радикал (начиная с простейшего) и при помощи цифр указать их место в у нумерованных атомов углерода. Если у одного и того же атома углерода находятся два одинаковых радикала, номер повторяют дважды:
2,2-диметил…
3. Полное название данному углеводороду дать по числу атомов углерода в нумерованной цепи:
2,2-диметилбутан |
| Слайд №10 |
 |
Физические свойства алканов
Температуры плавления и кипения увеличиваются с молекулярной массой и длиной главной углеродной цепи.
При нормальных условиях неразветвлённые алканы с CH4 до C4H10 — газы; с C5H12 до C13H28 — жидкости; начиная с C14H30 и далее — твёрдые вещества.
Температуры плавления и кипения понижаются от менее разветвленных к более разветвленным. Так, например, при 20°C н-пентан — жидкость, а неопентан — газ.
Газообразные алканы горят бесцветным или бледно-голубым пламенем с выделением большого количества тепла. |
| Слайд №11 |
 |
Химические свойства алканов
CH4 + 2O2 ? CO2 + 2H2O + Q
CH4 + Cl2 ? CH3Cl + HCl
xлорметан
CH3Cl + Cl2 ? CH2Cl2 + HCl
дихлорметан
CH2Cl2 + Cl2 ? CHCl3 + HCl
трихлорметан
CHCl3 + Cl2 ? CCl4 + HCl
тетрахлорметан |
| Слайд №12 |
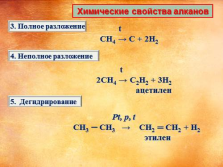 |
Химические свойства алканов
t
CH4 ? C + 2H2
t
2CH4 ? C2H2 + 3H2
ацетилен
Pt, p, t
CH3 ? CH3 ? CH2 ? CH2 + H2
этилен |
| Слайд №13 |
 |
Химические свойства алканов
Углеводороды нормального строения под влиянием катализаторов и при нагревании подвергаются реакциям изомеризации и превращаются в углеводороды разветвленного строения.
t,AlCl3
CH3?CH2?CH2?CH2?CH3 ? CH3?CH?CH2?CH3
?
CH3
2-метилбутан |
| Слайд №14 |
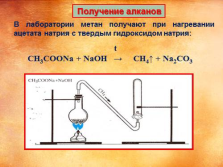 |
Получение алканов
В лаборатории метан получают при нагревании ацетата натрия с твердым гидроксидом натрия:
t
CH3COONa + NaOH ? CH4? + Na2CO3 |
| Слайд №15 |
 |
Получение алканов
Этан и другие предельные углеводороды с более длинной углеродной цепью можно получить при взаимодействии однородных галогенопроизводных предельных углеводородов с металлическим натрием:
CH3 ? I Na
+ ? CH3 ? CH3 + 2NaI
CH3 ? I Na
иодометан этан
Реакция Вюрца |
| Слайд №16 |
 |
Применение алканов
1. Картриджи.
2. Резина.
3. Типографская краска.
4. Растворители.
5. Хладагенты (фреоны).
6. Метанол.
7. Ацетилен. |
| Слайд №17 |
 |
Применение алканов
Топливо |
| Слайд №18 |
 |
Использованные источники
О.С.Габриелян. Химия. 10 класс. Базовый уровень. М. Дрофа. 2013.
2. Г.Е.Рудзитис, Ф.Г.Фельдман. Химия. 10 класс. М. Просвещение. 2012.
Картинка «получение алканов» слайд 14:
http://dist-tutor.info/mod/book/view.php?id=28450&chapterid=1598
Картинка «применение алканов» слайд 16:
http://www.alhimikov.net/organikbook/alcan_01.html
|
Оцените статью:
(5 голосов, среднее: 4.8 из 5)
Поделитесь с друзьями!
Большой сборник презентаций в помощь школьнику.
закрыть
Скопируйте этот код и вставьте его на своем сайте:

