Алкины
Слайды и текст этой презентации
| Слайд №1 |
 |
Алкины
Строение алкинов.
Номенклатура алкинов.
Физические свойства.
Химические свойства.
|
| Слайд №2 |
 |
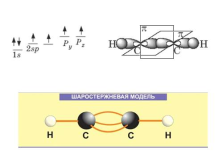
Алкины —
непредельные углеводороды, молекулы которых содержат, помимо одинарных связей, одну тройную углерод-углеродную связь.
Общая формула: CnH2n-2 |
| Слайд №3 |
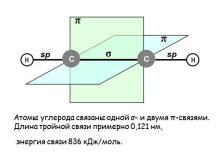 |
Атомы углерода связаны одной ?- и двумя ?-связями.Длина тройной связи примерно 0,121 нм, энергия связи 836 кДж/моль. |
| Слайд №4 |
 |
|
| Слайд №5 |
 |
Номенклатура алкинов
Простейшим алкином является этин (ацетилен C2H2).
По номенклатуре IUPAC названия алкинов образуются от названий соответствующих алканов заменой суффикса «-ан» на «-ин»;
положение тройной связи указывается арабскими цифрами. |
| Слайд №6 |
 |
Из приведенного перечня веществ выпишите в тетрадь алкины и дайте им названия по номенклатуре IUPAC |
| Слайд №7 |
 |
Изомерия алкинов
1. Структурная изомерия:
Изомерия углеродного скелета (пентин-1, 3-метилбутин-1);
Изомерия положения кратной связи (бутин-1, бутин-2).
2. Межклассовая изомерия:
Алкины;
Алкадиены (диены)
Например, гексин-1 и гексадиен-1,3
|
| Слайд №8 |
 |
Физические свойства
низшие (до С4) — газы без цвета и запаха,
плохо растворимы в воде,
лучше — в органических растворителях. |
| Слайд №9 |
 |
Ацетилен (по ИЮПАК — этин) C2H2
Физические свойства:
бесцветный газ,
малорастворим в воде,
легче воздуха.
Температура кипения ? 83,8 °C.
При сжатии разлагается со взрывом,
Взрывоопасный.
|
| Слайд №10 |
 |
Способы получения ацетилена
Ацетилен был открыт Г. Дэви в 1836 году в продуктах разложения метана, под действием искровых электрических разрядов
В 1860 г. М. Бертло синтезировал ацетилен из простых веществ, пропуская водород через электрическую дугу между угольными электродами.
В 1862 г. Ф. Велер получил ацетилен из карбида кальция, действуя на него водой.
Напишите уравнения реакций. |
| Слайд №11 |
 |
Способы получения ацетилена
3.
Карбидный способ
|
| Слайд №12 |
 |
Химические свойства:
Горение
Температура ацетилено-кислородного пламени достигает 3200°С.
Используют для резки и сварки металлов.
2С2Н2 + 5О2 4СО2 + 2Н2О |
| Слайд №13 |
 |
Реакции присоединения
Гидрирование.
Галогенирование (2 стадии).
Гидратация.
Гидрогалогенирование.
|
| Слайд №14 |
 |
|
| Слайд №15 |
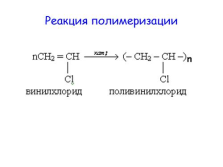 |
Реакция полимеризации |
| Слайд №16 |
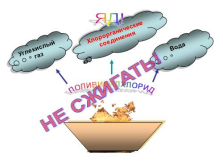 |
ПОЛИВИНИЛХЛОРИД
Углекислый газ
Хлорорганические соединения
Вода
ЯД!
НЕ СЖИГАТЬ! |
| Слайд №17 |
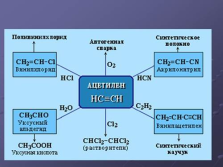 |
|
| Слайд №18 |
 |
Интернет-ресурсы:
http://ru.wikipedia.org/wiki/%C0%EB%EA%E8%ED%FB
http://festival.1september.ru/articles/563606/
http://900igr.net/datas/khimija/Atsetilen/0010-010-Gaz-atsetilen.jpg
|
Оцените статью:
(3 голоса, среднее: 2.7 из 5)
Поделитесь с друзьями!
Большой сборник презентаций в помощь школьнику.
закрыть
Скопируйте этот код и вставьте его на своем сайте:

