Азотная кислота и её свойства
Скачать презентацию (0.4 мб)
Слайды и текст этой презентации
Сегодня на уроке мы должны:записать молекулярную и структурную формулы азотной кислоты;
изучить химические свойства азотной кислоты в свете ОВР; выяснить признаки взаимодействия концентрированной азотной кислоты с Ме(Cu, Fe);
познакомиться с основными этапами промышленного получения кислоты и особенностями их проведения;
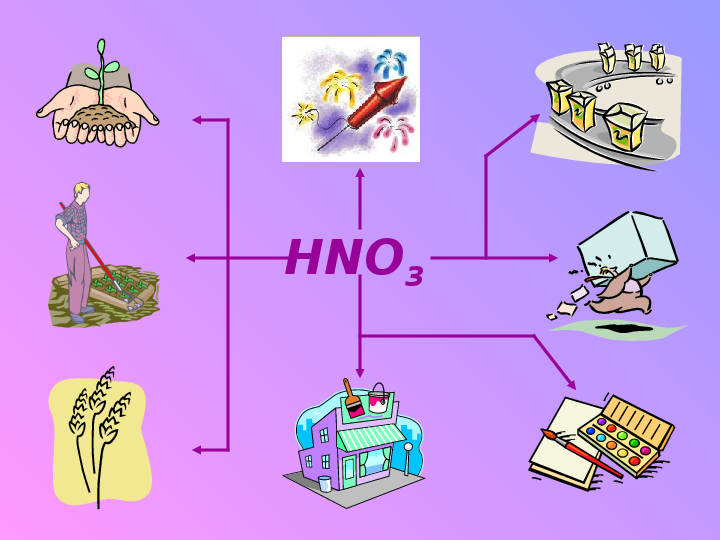
узнать, насколько важно производство данной кислоты для народного хозяйства нашей страны и для каждого человека в отдельности;
изучить химические свойства азотной кислоты в свете ОВР; выяснить признаки взаимодействия концентрированной азотной кислоты с Ме(Cu, Fe);
познакомиться с основными этапами промышленного получения кислоты и особенностями их проведения;
узнать, насколько важно производство данной кислоты для народного хозяйства нашей страны и для каждого человека в отдельности;
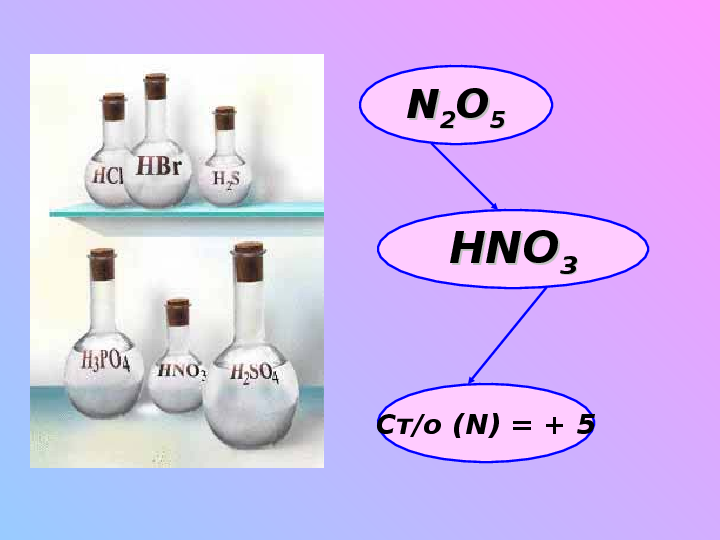
Строение и свойства молекулы азотной кислоты:«дымится на воздухе», на свету желтеет, т. к. подвергается разложению
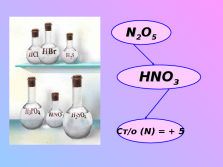
Сильная кислота – сильный окислитель (ст/о = +5)
Mr(HNO3) = 63
жидкость;
Сильная кислота – сильный окислитель (ст/о = +5)
Mr(HNO3) = 63
жидкость;
4HNO3 = 2H2O +4NO2 + O2
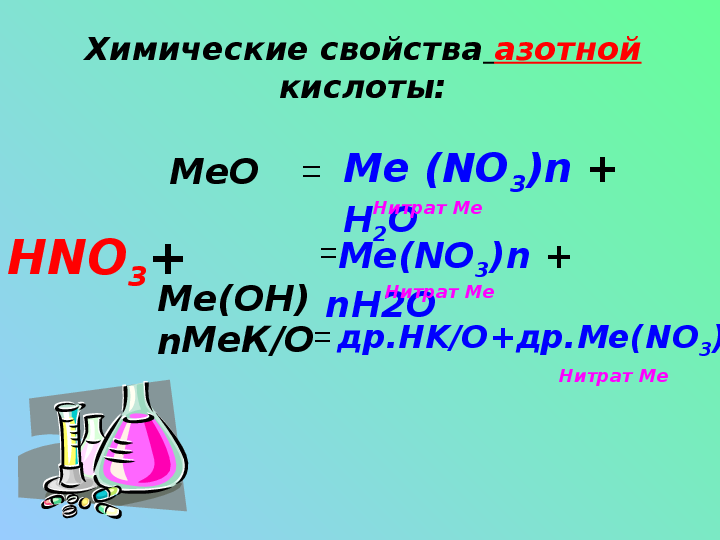
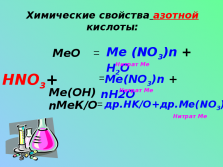
Химические свойства азотной кислоты:HNO3+
Me(OH)n
MeК/О
MeO
=
=
=
Me (NO3)n + H2O
Me(NO3)n + nH2O
др.HK/O+др.Me(NO3)n
Нитрат Ме
Нитрат Ме
Нитрат Ме
Свойства концентрированной азотной кислоты:Cu + 4HNO3 = Cu(NO3)2+2H2O + 2NO2
( конц.)
Cu 0 ——— Cu +2
N +5 ——— N +4
+ 2 e
— 1 е
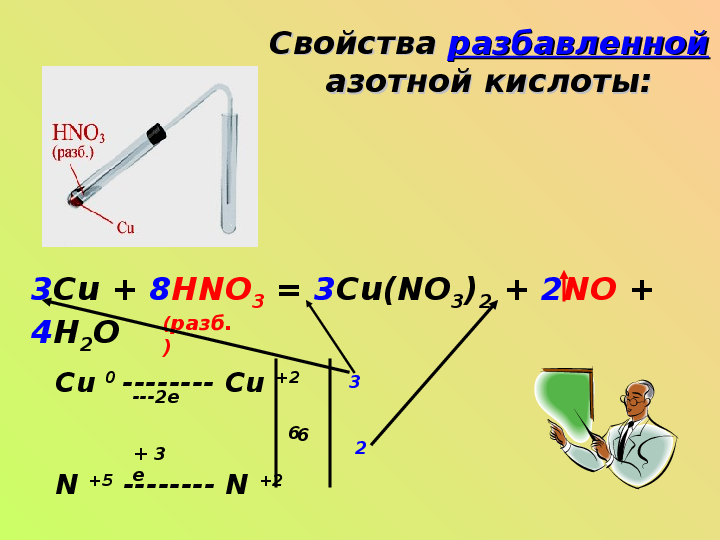
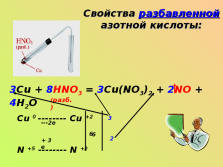
Свойства разбавленной азотной кислоты:3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O
(разб.)
Cu 0 ——— Cu +2
N +5 ——— N +2
—2e
+ 3 e
6
6
3
2
Специфические химические свойства концентрированной азотной кислотыFe , Al + HNO3 —- НЕ ВЗАИМОДЕЙСТВУЮТ,
т.к. образуют защитную пленку ==
ПАССИВИРОВАНИЕ хранение и
транспортировка азотной кислоты.
т.к. образуют защитную пленку ==
ПАССИВИРОВАНИЕ хранение и
транспортировка азотной кислоты.
Au + HNO3 + 3HCL = AuCl3 + NO + 2H2O
« царская водка»
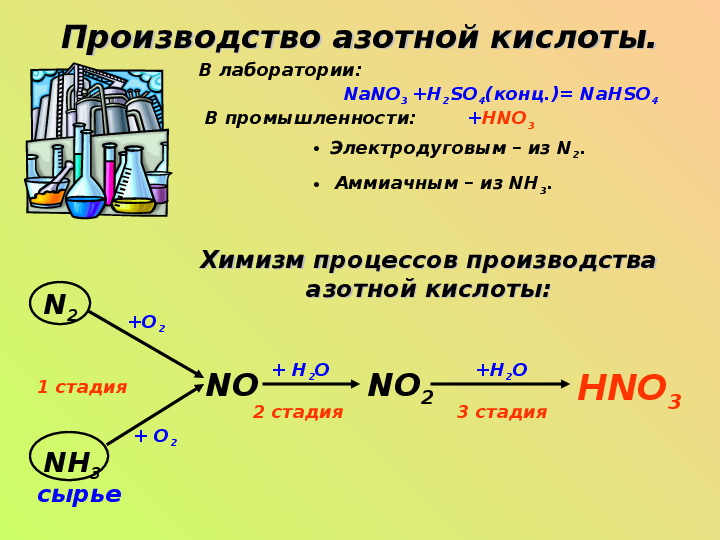
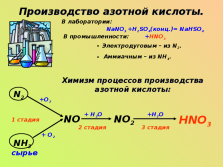
Производство азотной кислоты.В лаборатории:
NaNO3 +H2SO4(конц.)= NaHSO4 +HNO3
В промышленности:
Электродуговым – из N2.
Аммиачным – из NH3.
Химизм процессов производства азотной кислоты:
N2
NH3
NO
NO2
HNO3
сырье
1 стадия
2 стадия
3 стадия
+О2
+ О2
+ Н2О
+Н2О
Составьте практически осуществимые уравнения реакций азотной кислоты с веществами, формулы которых:
Na2SiO3 ————————————- Л
BaCl2 —————————————— С
Ca(OH)2 ————————————— Я
Al2O3 —————————————— М
CaCO3 ————————————— П
CO2 —————————————— Ю
Fe(OH)3 ————————————— И
CuO ——————————————- С
Из букв, соответствующих правильным ответа, вы составите название соли азотной кислоты, которую применяют в медицине для прижигания ран:
Na2SiO3 ————————————- Л
BaCl2 —————————————— С
Ca(OH)2 ————————————— Я
Al2O3 —————————————— М
CaCO3 ————————————— П
CO2 —————————————— Ю
Fe(OH)3 ————————————— И
CuO ——————————————- С
Из букв, соответствующих правильным ответа, вы составите название соли азотной кислоты, которую применяют в медицине для прижигания ран: