Азотная кислота
Скачать презентацию (2.67 мб)
Слайды и текст этой презентации
— Это вещество было описано арабским химиком в VIII веке Джабиром ибн Хайяном (Гебер) в его труде «Ямщик мудрости», а с ХV века это вещество добывалось для производственных целей.- Это вещество было описано арабским химиком в VIII веке Джабиром ибн Хайяном (Гебер) в его труде «Ямщик мудрости», а с ХV века это вещество добывалось для производственных целей.
— Благодаря этому веществу русский учёный В.Ф. Петрушевский в 1866 году впервые получил динамит.
— Это вещество – прародитель большинства взрывчатых веществ (например, тротила, или тола).
— Это вещество является компонентом ракетного топлива, его использовали для двигателя первого в мире советского реактивного самолёта БИ – 1.
— Это вещество в смеси с соляной кислотой растворяет платину и золото, признанное «царём» металлов. Сама смесь, состоящая из 1-ого объёма этого вещества и 3-ёх объёмов соляной кислоты, называется «царской водкой».
— Благодаря этому веществу русский учёный В.Ф. Петрушевский в 1866 году впервые получил динамит.
— Это вещество – прародитель большинства взрывчатых веществ (например, тротила, или тола).
— Это вещество является компонентом ракетного топлива, его использовали для двигателя первого в мире советского реактивного самолёта БИ – 1.
— Это вещество в смеси с соляной кислотой растворяет платину и золото, признанное «царём» металлов. Сама смесь, состоящая из 1-ого объёма этого вещества и 3-ёх объёмов соляной кислоты, называется «царской водкой».
НЕМНОГО ИСТОРИИМонах-алхимик Бонавентура в 1270 году в поисках универсального растворителя «алкагеста» решил нагреть смесь железного купороса с селитрой. Сосуд, в котором была смесь, вскоре наполнился красно-бурым «дымом». Монах в изумлении застыл, затем убрал огонь и увидел, как в колбу-приемник стала капать желтоватая жидкость. Она действовала на все металлы, даже на серебро и ртуть. Алхимики думали, что сидящий в жидкости рыжий дым является демоном, управляющим одной из стихий природы – водой. Поэтому желтоватую жидкость называли «крепкой водой» или «крепкой водкой». Это название сохранилось до времен М. В. Ломоносова. Как сейчас называют это вещество?
HNO3 – азотная кислотаФизические свойства
1. Молярная масса 63,016 г/моль
2. Бесцветная жидкость с резким запахом, «дымит» на воздухе, Т кип. = 86
3. Хорошо растворима в воде (сильная одноосновная
кислота)
4. Молекула имеет
плоскую структуру
5.Валентность (N)=IV
6. Степень окисления (N)=+5
1. Молярная масса 63,016 г/моль
2. Бесцветная жидкость с резким запахом, «дымит» на воздухе, Т кип. = 86
3. Хорошо растворима в воде (сильная одноосновная
кислота)
4. Молекула имеет
плоскую структуру
5.Валентность (N)=IV
6. Степень окисления (N)=+5
Общие с другими кислотами1) Изменяет цвет индикаторов (диссоциация)
HNO3
2) Взаимодействие с основными и амфотерными оксидами
HNO3
2) Взаимодействие с основными и амфотерными оксидами
CuO+2HNO3
3) Взаимодействие с основаниями и аммиаком
KOH+HNO3
NH3+HNO3
4) Взаимодействие с солями
Na2CO3+2HNO3
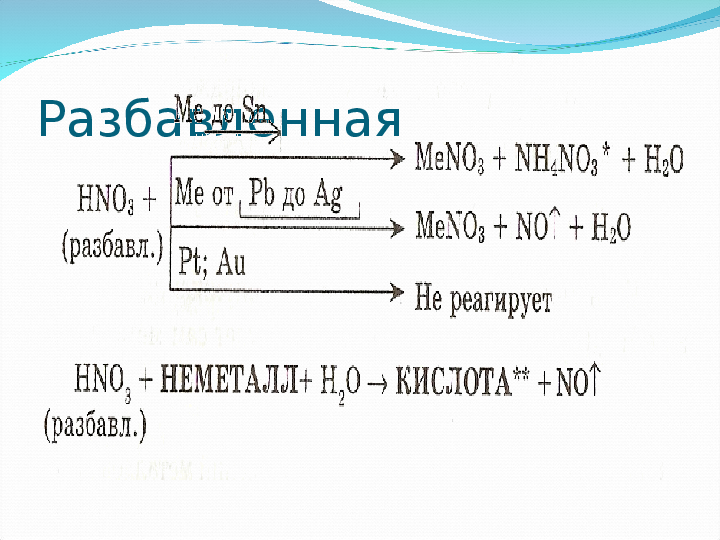
Специфические свойства – взаимодействие с металламиЗАПОМНИ!
При взаимодействии азотной кислоты любой концентрации с металлами водород никогда не выделяется. Продукты зависят от металла и концентрации кислоты.
При взаимодействии азотной кислоты любой концентрации с металлами водород никогда не выделяется. Продукты зависят от металла и концентрации кислоты.
Взаимодействие с неметалламиВзаимодействие с неметаллами
При взаимодействии с неметаллами образуется кислота, в которой у неметалла высшая степень окисления, и продукт по схеме:
При взаимодействии с неметаллами образуется кислота, в которой у неметалла высшая степень окисления, и продукт по схеме:
NO неMe + HNO3 NO2
P+5HNO3(к.)H3PO4+5NO2+H2O
3P+5HNO3(р)+2H2O3H3PO4+5NO
Действие на органические веществаБелки при взаимодействии с конц.азотной кислотой разрушаются и приобретают жёлтую окраску .
Под действием азотной кислоты воспламеняются бумага, масло, древесина, уголь.
Под действием азотной кислоты воспламеняются бумага, масло, древесина, уголь.
Смесь концентрированных азотной и соляной кислот (соотношение по объему 1 :3) называется царской водкой; она растворяет даже благородные металлы.
Смесь HNO3 концентрации 100% и H2SO4 концентрации 96% при их соотношении по объему 9:1 называют меланжем.
Смесь HNO3 концентрации 100% и H2SO4 концентрации 96% при их соотношении по объему 9:1 называют меланжем.
ИспользованиеПроизводство:
NH4NO3
минеральных удобрений
нитратов Na, К, Са и др.
в гидрометаллургии
получение ВВ, H2SO4, H3PO4,
ароматических нитросоединений,
красителей,
ракетного топлива.
травление металлов,
получение полупроводников
NH4NO3
минеральных удобрений
нитратов Na, К, Са и др.
в гидрометаллургии
получение ВВ, H2SO4, H3PO4,
ароматических нитросоединений,
красителей,
ракетного топлива.
травление металлов,
получение полупроводников