Ионные уравнения
Слайды и текст этой презентации
| Слайд №1 |
 |
Ионные уравнения
Автор: учитель химии
МКОУ «Касторенская СОШ №1»,
п.г.т. Касторное
Парамонов А.Ю., 2014
|
| Слайд №2 |
 |
Цели урока:
1)Познакомить учащихся с понятием ионные уравнения и ионные реакции;
2)рассмотреть случаи, при которых реакции ионного обмена протекают до конца;
3)продолжить формирование умений составлять уравнения химических реакций;
4)развивать познавательный интерес при выполнении теоретических и практических заданий. |
| Слайд №3 |
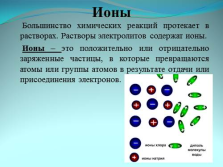 |
Ионы
Большинство химических реакций протекает в растворах. Растворы электролитов содержат ионы.
Ионы – это положительно или отрицательно заряженные частицы, в которые превращаются атомы или группы атомов в результате отдачи или присоединения электронов. |
| Слайд №4 |
 |
.
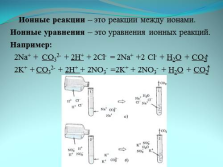
Ионные реакции – это реакции между ионами.
Ионные уравнения – это уравнения ионных реакций.
Например:
2Na+ + CO32- + 2H+ + 2Cl- = 2Na+ +2 Cl- + H2O + CO2
2K+ + CO32- + 2H+ + 2NO3- =2K+ + 2NO3- + H2O + CO2
|
| Слайд №5 |
 |
.
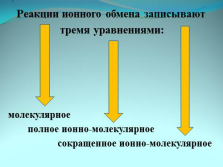
Реакции ионного обмена записывают
тремя уравнениями:
молекулярное
полное ионно-молекулярное
сокращенное ионно-молекулярное
|
| Слайд №6 |
 |
.
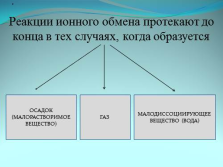
Реакции ионного обмена протекают до конца в тех случаях, когда образуется
ОСАДОК
(МАЛОРАСТВОРИМОЕ ВЕЩЕСТВО)
ГАЗ
МАЛОДИССОЦИИРУЮЩЕЕ ВЕЩЕСТВО (ВОДА) |
| Слайд №7 |
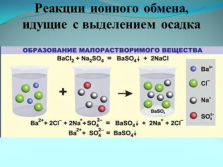 |
Реакции ионного обмена, идущие с выделением осадка |
| Слайд №8 |
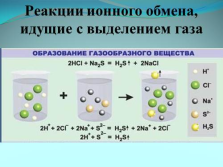 |
Реакции ионного обмена, идущие с выделением газа |
| Слайд №9 |
 |
|
| Слайд №10 |
 |
.
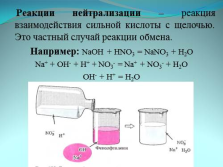
Реакции нейтрализации – реакция взаимодействия сильной кислоты с щелочью. Это частный случай реакции обмена.
Например: NaOH + HNO3 = NaNO3 + H2O
Na+ + OH- + H+ + NO3- = Na+ + NO3- + H2O
OH- + H+ = H2O
|
| Слайд №11 |
 |
Обобщение темы
Тест «Проверь себя»:
1) Ионные реакции – это реакции между:
а) нейтральными атомами б) ионами
в) молекулами г) протонами
2) Реакции нейтрализации – частный случай реакции:
а) обмена б) замещения
в) соединения г) разложения
3) Какое из приведенных веществ выпадает в осадок:
а) MgS б) KОН
в) HNO3 г) Na2SO4
|
| Слайд №12 |
 |
.
4) Какое вещество надо добавить к соляной кислоте, чтобы в результате реакции выделился газ:
а) KOH б) NaOH
в) Na2CO3 г) AgNO3
5) Какое вещество является малодиссоциирующим:
а) H3PO4 б) KOH
в) Na2SO4 г) H2O
|
| Слайд №13 |
 |
Ответы:
1. б
2. а
3. а
4. в
5. г
|
| Слайд №14 |
 |
Домашнее задание:
§ 37, упр. 4, 5.
|
| Слайд №15 |
 |
Список источников
1) Габриелян О.С. Химия. 8 класс: учеб. для общеобразоват. учрежд. / О.С. Габриелян. – 16 изд., стереотип. – М.: Дрофа, 2010.-270 с., [2]с.: ил.
Использованы фотографии:
http://900igr.net/datai/fizika/Tok-v-rastvorakh/0011-001-Skhema-elektroliticheskoj-dissotsiatsii.gif
ионы хлорид натрия
http://pochit.ru/matematika/71334/index.html
образование малорастворимого вещества
образование газообразного вещества
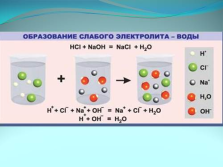
образование слабого электролита — воды |
Оцените статью:
(0 голосов, среднее: 0 из 5)
Поделитесь с друзьями!
Большой сборник презентаций в помощь школьнику.
закрыть
Скопируйте этот код и вставьте его на своем сайте:

