Щелочные металлы
Слайды и текст этой презентации
| Слайд №1 |
 |
Щелочные металлы
|
| Слайд №2 |
 |
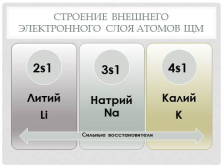
Строение и свойства атомов
Число энергетических уровней Увеличивается
Число электронов на внешнем уровне Не изменяется, равно номеру группы (1)
Электроотрицательность ————————
Высшая степень окисления Равна +1
Металлические свойства Увеличиваются
Восстановительные свойства Увеличиваются |
| Слайд №3 |
 |
ЛИТИЙ РУБИДИЙ
НАТРИЙ
РУБИДИЙ
КАЛИЙ ЦЕЗИЙ |
| Слайд №4 |
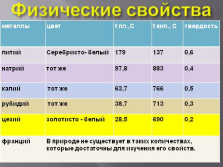 |
Физические свойства
металлы цвет t пл.,С t кип., C твердость
литий Серебристо- белый 179 137 0,6
натрий тот же 97,8 883 0,4
калий тот же 63,7 766 0,5
рубидий тот же 38,7 713 0,3
цезий золотисто — белый 28,5 690 0,2
франций В природе не существует в таких количествах, которые достаточны для изучения его свойств. В природе не существует в таких количествах, которые достаточны для изучения его свойств. В природе не существует в таких количествах, которые достаточны для изучения его свойств. В природе не существует в таких количествах, которые достаточны для изучения его свойств. |
| Слайд №5 |
 |
Физические свойства
Все металлы этой подгруппы очень мягкие, их можно резать ножом.
Литий, натрий и калий легче воды и плавают на её поверхности, реагируя с ней. |
| Слайд №6 |
 |
Натриевый пояс земли
На Земле натрий никогда не встречается в свободном состоянии – слишком активен этот металл.
Но в верхних слоях атмосферы – на высоте около 80 км – обнаружен слой атомарного натрия. На такой высоте практически нет кислорода, паров воды и вообще ничего, с чем натрий мог бы вступить в реакцию. Спектральными методами натрий был обнаружен и в межзвездном пространстве. |
| Слайд №7 |
 |
ХИМИЧЕСКИЕ СВОЙСТВА
Из-за высокой химической активности
щелочных металлов хранят под слоем керосина. |
| Слайд №8 |
 |
1. ВЗАИМОДЕЙСТВИЕ С ВОДОЙ
Важное свойство щелочных металлов — их высокая активность по отношению к воде. Наиболее спокойно (без взрыва) реагирует с водой литий. |
| Слайд №9 |
 |
2. С неметаллами
С водородом образуют гидриды.
Бурно реагируют с хлором и серой.
|
| Слайд №10 |
 |
С кислородом:
Только литий сгорает на воздухе с образованием оксида:
При горении натрияобразуется
пероксид натрия
При горения калия, рубидия и цезия
образуетсяв основном надпероксиды:
|
| Слайд №11 |
 |
Гидроксиды щелочных металлов — белые вещества,водные растворы
которых являются сильными
основаниями.
Они участвуют во всех реакциях, характерных для оснований. |
| Слайд №12 |
 |
|
| Слайд №13 |
 |
|
| Слайд №14 |
 |
Карбонат и гидрокарбонат натрия
Карбонат натрия- Na2CO3 используется в стекольном производстве, мыловарении, в производстве стиральных и чистящих порошков, эмалей .
Гидрокарбонат натрия NaHCO3 (другие названия: питьевая сода(E500), пищевая сода, бикарбонат натрия, натрий двууглекислый). |
| Слайд №15 |
 |
Интересные факты
ДЛЯ ЧЕГО НУЖЕН ЦИАНИСТЫЙ КАЛИЙ? (KCNS)
Для извлечения золота и серебра из руд. Для гальванического золочения и серебрения неблагородных металлов.
Для получения многих органических веществ. |
| Слайд №16 |
 |
Цезий
Открыт цезий сравнительно недавно, в 1860 г. За короткий исторический срок прошел блистательный путь – от редкого, никому не ведомого химического элемента до стратегического металла.
«Работает» в нескольких отраслях:
в электронике и автоматике, в радиолокации и кино, в атомных реакторах и на космических кораблях… |
| Слайд №17 |
 |
Рубидий — металл, который можно назвать химической недотрогой. От соприкосновения с воздухом он самопроизвольно воспламеняется и сгорает ярким розовато-фиолетовым пламенем. Рубидий — радиоактивный элемент, он медленно испускает поток электронов, превращаясь в стронций.
Под влиянием лучей света рубидий становится источником электрического тока.
|
| Слайд №18 |
 |
|
| Слайд №19 |
 |
Хлорид натрия известен в быту под названием поваренной соли. Хлорид натрия в значительном количестве содержится в морской воде, создавая её солёный вкус. Встречается в природе в виде минерала галита (каменная соль).
Применяется для получения неорганических веществ, соды, в пищевой промышленности, в производстве мыла.
ХЛОРИД НАТРИЯ |
Оцените статью:
(4 голоса, среднее: 3 из 5)
Поделитесь с друзьями!
Большой сборник презентаций в помощь школьнику.
закрыть
Скопируйте этот код и вставьте его на своем сайте:

