| Слайд №2 |
 |
12.06.2014
2
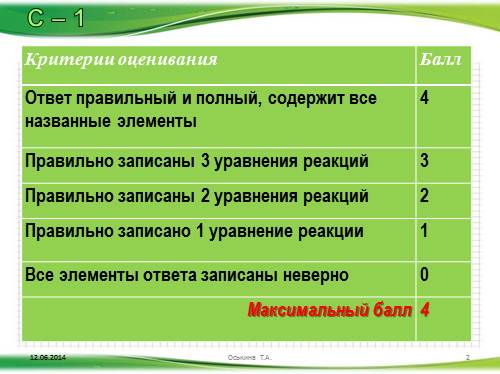
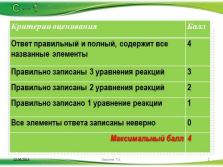
Критерии оценивания Балл
Ответ правильный и полный, содержит все названные элементы 4
Правильно записаны 3 уравнения реакций 3
Правильно записаны 2 уравнения реакций 2
Правильно записано 1 уравнение реакции 1
Все элементы ответа записаны неверно 0
Максимальный балл 4
Оськина Т.А.
С – 1 |
| Слайд №3 |
 |
Даны схемы превращений.Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для первого превращения в каждой цепочке составьте сокращённое ионное уравнение реакции.
12.06.2014
3
CuCl2 ? X ? Cu(NO3)2 ? Cu
1)
Fe2(SO4)3 ?X ? Fe2O3 ? Fe
2)
AlCl3 ? Al(OH)3 ? X ? AgCl
3)
С – 1
Na2SO3 ? X ? SO3 ? BaSO4
4)
5)
Fe(OH)2 ? FeCl2 ? X ? Fe(OH)3
Р
Е
Ш
Е
Н
И
Я
Оськина Т.А. |
| Слайд №4 |
 |
Даны схемы превращений.Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения в каждой цепочке составьте сокращённое ионное уравнение реакции.
12.06.2014
4
CaO ? X ? CaCO3 ? CO2
6)
Zn ? ZnCl2 ? X ? ZnO
7)
Ca(OH)2 ?CaCO3? X ? Na2CO3
8)
С – 1
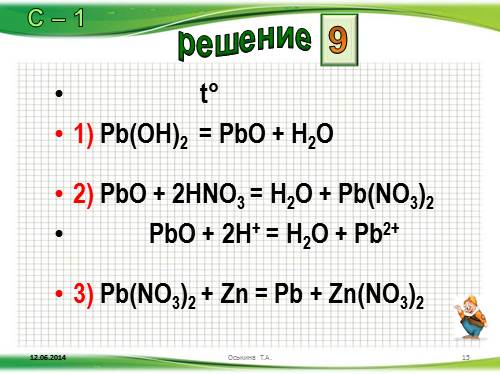
Pb(OH)2 ? X ? Pb(NO3)2 ? Pb
9)
10)
Na ? NaOH ? X ? BaSO3
Р
Е
Ш
Е
Н
И
Я
Оськина Т.А. |
| Слайд №5 |
 |
Даны схемы превращений.Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения в каждой цепочке составьте сокращённое ионное уравнение реакции.
12.06.2014
5
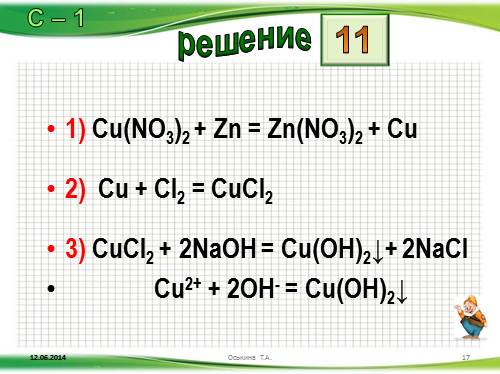
Cu(NO3)2 ? Cu ?X ?Cu(OH)2
11)
SO2 ? X ? H2SO4 ? BaSO4
12)
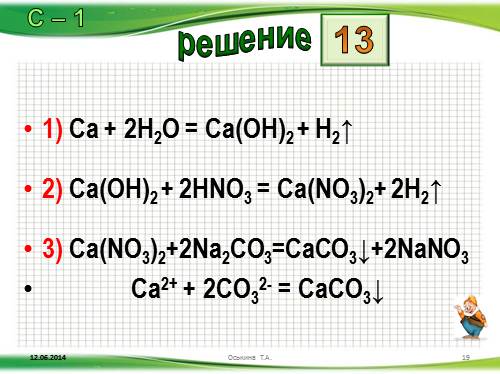
Ca ? X ? Ca(NO3)2 ? CaCO3
13)
С – 1
KBr ? X ? HBr ? AgBr
14)
15)
H2S ? X ? SO3 ? K2SO4
Р
Е
Ш
Е
Н
И
Я
Оськина Т.А. |
| Слайд №6 |
 |
Даны схемы превращений.Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения в каждой цепочке составьте сокращённое ионное уравнение реакции.
12.06.2014
6
CuSO4 ? X ? CuO ? Cu(NO3)2
16)
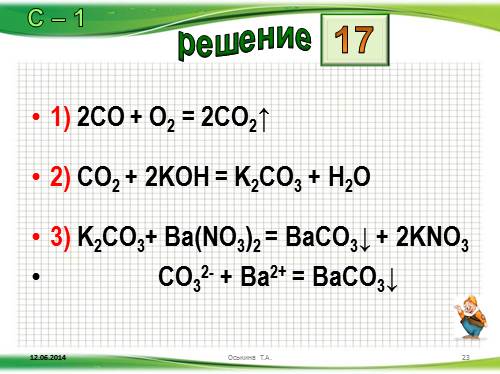
CO ? X ? K2CO3 ? BaCO3
17)
Cl2 ? HCl ? X ? AgCl
18)
С – 1
N2 ? X ? NH4Cl ? NH4NO3
19)
20)
MgO ? Mg(NO3)2 ? X ? MgCl2
Р
Е
Ш
Е
Н
И
Я
Оськина Т.А. |
| Слайд №7 |
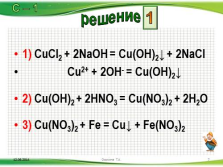 |
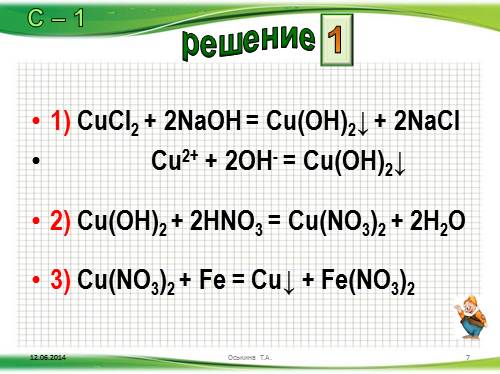
1) CuCl2 + 2NaOH = Cu(OH)2? + 2NaCl
Cu2+ + 2OH- = Cu(OH)2?
2) Cu(OH)2 + 2HNO3 = Cu(NO3)2 + 2H2O
3) Cu(NO3)2 + Fe = Cu? + Fe(NO3)2
12.06.2014
7
1
решение
С – 1
Оськина Т.А. |
| Слайд №8 |
 |
1) Fe2(SO4)3 +6NaOH =2Fe(OH)3?+ 3Na2SO4
Fe3+ + 6OH- = 2Fe(OH)3 ?
2) 2Fe(OH)3 = Fe2O3 + 3H2O
(при нагревании)
3) Fe2O3 + 3CO = 2Fe + 3CО2?
(при нагревании; в качестве восстановителя могут быть использованы Н2, Al и др.)
12.06.2014
8
2
решение
С – 1
Оськина Т.А. |
| Слайд №9 |
 |
1) AlCl3 + 3NaOH = Al(OH)3? + 3NaCl
Al3+ + 3OH- = Al(OH)3?
2) Al(OH)3 + 3HCl = AlCl3 + 3H2O
3) AlCl3 + 3AgNO3 = 3AgCl? + Al(NO3)3
12.06.2014
9
3
решение
С – 1
Оськина Т.А. |
| Слайд №10 |
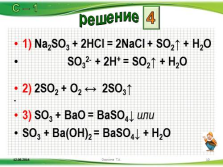 |
1) Na2SO3 + 2HCl = 2NaCl + SO2? + H2O
SO32- + 2H+ = SO2? + H2O
2) 2SO2 + O2 ? 2SO3?
3) SO3 + BaO = BaSO4? или
SO3 + Ba(OH)2 = BaSO4? + H2O
12.06.2014
10
4
решение
С – 1
Оськина Т.А. |
| Слайд №11 |
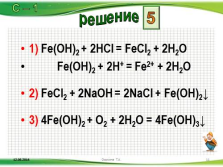 |
1) Fe(OH)2 + 2HCl = FeCl2 + 2H2O
Fe(OH)2 + 2H+ = Fe2+ + 2H2O
2) FeCl2 + 2NaOH = 2NaCl + Fe(OH)2?
3) 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3?
12.06.2014
11
5
решение
С – 1
Оськина Т.А. |
| Слайд №12 |
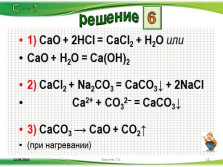 |
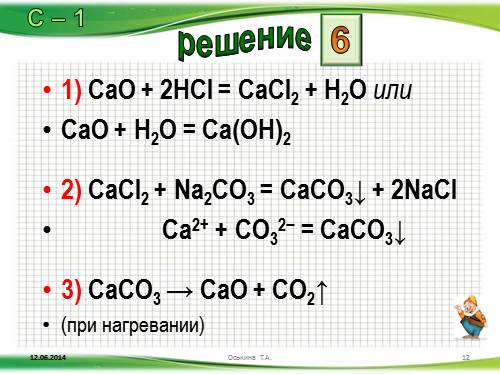
1) CaO + 2HCl = CaCl2 + H2O или
CaO + H2O = Ca(OH)2
2) CaCl2 + Na2CO3 = CaCO3? + 2NaCl
Ca2+ + CO32? = CaCO3?
3) CaCO3 ? CaO + CO2?
(при нагревании)
12.06.2014
12
6
решение
С – 1
Оськина Т.А. |
| Слайд №13 |
 |
1) Zn + 2HCl = ZnCl2 + H2?
2) ZnCl2 + 2NaOH = Zn(OH)2? + 2NaCl
Zn2+ + 2OH- = Zn(OH)2?
3) Zn(OH)2 = ZnO + H2O (нагревание)
12.06.2014
13
7
решение
С – 1
Оськина Т.А. |
| Слайд №14 |
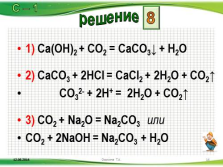 |
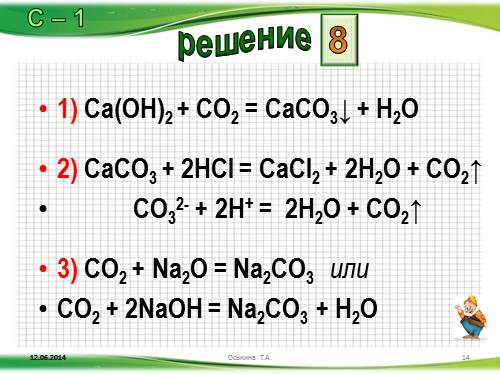
1) Ca(OH)2 + CO2 = CaCO3? + H2O
2) CaCO3 + 2HCl = CaCl2 + 2H2O + CO2?
CO32- + 2H+ = 2H2O + CO2?
3) CO2 + Na2O = Na2CO3 или
CO2 + 2NaOH = Na2CO3 + H2O
12.06.2014
14
8
решение
С – 1
Оськина Т.А. |
| Слайд №15 |
 |
t°
1) Pb(OH)2 = PbО + H2O
2) PbО + 2НNO3 = H2O + Pb(NO3)2
PbО + 2Н+ = H2O + Pb2+
3) Pb(NO3)2 + Zn = Pb + Zn(NO3)2
12.06.2014
15
9
решение
С – 1
Оськина Т.А. |
| Слайд №16 |
 |
1) 2Na + 2H2O = 2NaOH + H2?
2) 2NaOH + SO2 = Na2SO3 + H2O
2OH- + SO2 = SO32- + H2O
3) Na2SO3 + BaCl2 = BaSO3 + 2NaCl
12.06.2014
16
10
решение
С – 1
Оськина Т.А. |
| Слайд №17 |
 |
1) Cu(NО3)2 + Zn = Zn(NО3)2 + Сu
2) Сu + Сl2 = СuСl2
3) СuСl2 + 2NaOH = Сu(ОН)2?+ 2NaCl
Cu2+ + 2OH- = Cu(OH)2?
12.06.2014
17
11
решение
С – 1
Оськина Т.А. |
| Слайд №18 |
 |
1) 2SO2 + O2 = 2SO3?
2) SO3 + H2O = H2SO4
3) H2SO4 + BaCl2 = BaSO4? + 2HCl
SO42? + Ba2+ = BaSO4?
12.06.2014
18
12
решение
С – 1
Оськина Т.А. |
| Слайд №19 |
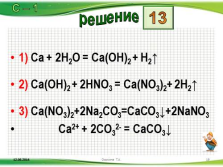 |
1) Ca + 2H2O = Ca(OH)2 + H2?
2) Ca(OH)2 + 2HNO3 = Ca(NO3)2+ 2H2?
3) Ca(NO3)2+2Na2CO3=CaCO3?+2NaNO3
Ca2+ + 2CO32- = CaCO3?
12.06.2014
19
13
решение
С – 1
Оськина Т.А. |
| Слайд №20 |
 |
1) 2KBr + Cl2 = 2KCl + Br2
2) Br2 + H2 = 2HBr
3) HBr + AgNO3 = AgBr? + HNO3
Br- + Ag+ = AgBr?
12.06.2014
20
14
решение
С – 1
Оськина Т.А. |
| Слайд №21 |
 |
1) 2H2S + 3O2 = 2SO2? +2H2O
2) 2SO2 + O2 ? 2SO3?
3) SO3 + 2KOH = K2SO4 + H2O
SO3 + 2OH- = SO42- + H2O
12.06.2014
21
15
решение
С – 1
Оськина Т.А. |
| Слайд №22 |
 |
1) CuSO4 + Fe = Cu? + FeSO4
(вместо железа можно использовать другой металл средней активности)
2) 2Cu + O2 = 2CuO
3) CuO + 2HNO3 = Cu(NO3)2 + H2O
CuO + 2H+ = Cu2+ + H2O
12.06.2014
22
16
решение
С – 1
Оськина Т.А. |
| Слайд №23 |
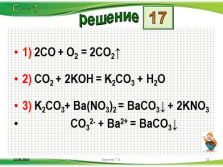 |
1) 2CO + O2 = 2CO2?
2) CO2 + 2KOH = K2CO3 + H2O
3) K2CO3+ Ba(NO3)2 = BaCO3? + 2KNO3
CO32- + Ba2+ = BaCO3?
12.06.2014
23
17
решение
С – 1
Оськина Т.А. |
| Слайд №24 |
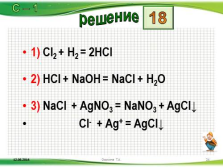 |
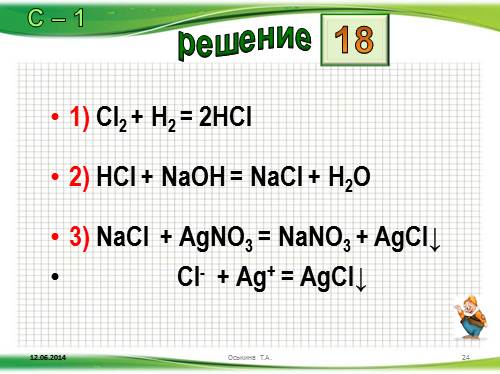
1) Cl2 + H2 = 2HCl
2) HCl + NaOH = NaCl + H2O
3) NaCl + AgNO3 = NaNO3 + AgCl?
Cl- + Ag+ = AgCl?
12.06.2014
24
18
решение
С – 1
Оськина Т.А. |
| Слайд №25 |
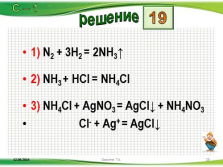 |
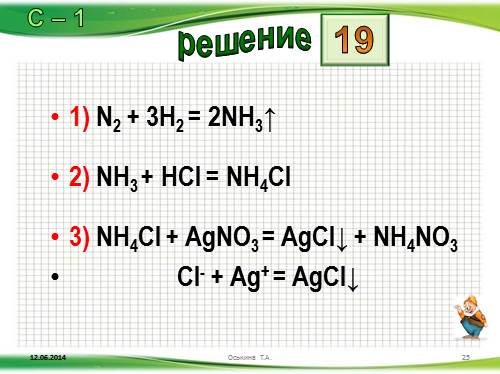
1) N2 + 3H2 = 2NH3?
2) NH3 + HCl = NH4Cl
3) NH4Cl + AgNO3 = AgCl? + NH4NO3
Cl- + Ag+ = AgCl?
12.06.2014
25
19
решение
С – 1
Оськина Т.А. |
| Слайд №26 |
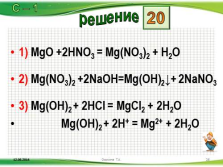 |
1) MgO +2HNO3 = Mg(NO3)2 + H2O
2) Mg(NO3)2 +2NaOH=Mg(OH)2?+ 2NaNO3
3) Mg(OH)2 + 2HCl = MgCl2 + 2H2O
Mg(OH)2 + 2H+ = Mg2+ + 2H2O
12.06.2014
26
20
решение
С – 1
Оськина Т.А. |
| Слайд №27 |
 |
Демонстрационные варианты ГИА 2010-2013 гг.
Тренировочные варианты экзаменационных работ для проведения государственной итоговой аттестации в новой форме/авт.-сост.Д.Ю.Добротин, А.А.Каверина. – М.: АСТ: Астрель, 2011.
ГИА 2011.Химия. 9 класс. Государственная итоговая аттестация (в новой форме). Типовые тестовые задания/ А.С.Корощенко, Ю.Н.Медведев. – М.: Издательство «Экзамен», 2011.
12.06.2014
Оськина Т.А.
27
http://fotki.yandex.ru/users/alexandrowa-anastasya2011/view/547318/?page=3 |