Химические свойства кислот
Слайды и текст этой презентации
| Слайд №1 |
 |
Na2CO3 Cu(OH)2 FeO
AlCl3 MgBr2 NaOH
CO2 NiO Ca(OH)2
HCl
H2SO4
H2SiO3 |
| Слайд №2 |
 |
Химические свойства кислот
Цель урока. Изучить химические свойства характерные для класса «Кислоты». |
| Слайд №3 |
 |
Домашнее задание
§38 по учебнику Габриелян О.С. Химия 8 класс.
Творческое задание (по желанию) приготовить презентацию на тему: «Действие кислот на наш организм».
На оценку «5» — зад. 3,6,7,8 на стр.135-138 (рабочая тетрадь)
На оценку «4» — зад. 3, 6,7 на стр.135-138 (рабочая тетрадь)
На оценку «3» — зад. 3, 7 на стр.135-138 (рабочая тетрадь)
|
| Слайд №4 |
 |
УЭ – 1.
Цель. Определить исходный уровень знаний о классификации кислот. Проверить умения составлять химические формулы кислот. |
| Слайд №5 |
 |
1 вариант
HCl – хлороводородная, соляная кислота H3PO4 – фосфорная, ортофосфорная кислота H2S – сероводородная кислота
(0,5 балла за каждый правильный ответ)
II. 1. HNO3 – азотная кислота
2. НF – фтороводородная, плавиковая кислота (1 балл за каждый правильный ответ)
III. Не диссоциирует на ионы
(1,5 балла за правильный ответ)
2 вариант
I. HI – йодоводородная кислота HNO2 – азотистая кислота H2SiO3 – кремниевая кислота
(0,5 балла за каждый правильный ответ)
II. 1. H2SO4 – серная кислота
2. Н2CO3 – угольная кислота
(1 балл за каждый правильный ответ)
III. HF = H+ + F-
(1,5 балла за правильный ответ)
Внесите заработанные баллы в листок учета знаний |
| Слайд №6 |
 |
УЭ – 2.
Цель. Изучить химические свойства кислот на основе экспериментальных опытов. |
| Слайд №7 |
 |
Правила техники безопасности при работе с кислотами:
1. Необходимо наливать в пробирку количество кислоты, которое указано в инструкции.
2. Заполнять пробирку можно только 1/3 объема.
3. Взбалтывать вещества следует, слегка покачивая пробиркой, не закрывая ее отверстие пальцем.
|
| Слайд №8 |
 |
4. При разбавлении концентрированной серной кислоты выделяется большое количество теплоты. Поэтому смешивать серною кислоту, добавляя ее в воду, а не наоборот.
5. Концентрированная серная кислота вызывает ожоги. Поэтому попавшую на кожу или ткань кислоту необходимо тотчас стряхнуть, смыть большим количеством воды, затем раствором питьевой соды и вновь смыть водой. |
| Слайд №9 |
 |
УЭ – 3.
Цель. Обсудить результаты опытов. Сделать выводы о химических свойствах кислот. |
| Слайд №10 |
 |
Химические свойства кислот
Действие кислот на индикаторы
лакмус
метилоранж
фенолфталеин |
| Слайд №11 |
 |
Химические свойства кислот
Кислота + металл = соль + водород
Ряд активности металлов:
Li K Ba Ca Na Mg Al Zn Fe Sn Pb H Cu Hg Ag Pt Au
Опыт 1. Взаимодействие цинка с соляной кислотой
Опыт 2. Взаимодействие железа с соляной кислотой
Опыт 3. Взаимодействие меди с соляной кислотой
|
| Слайд №12 |
 |
Кислота + основной оксид = соль + вода
Химические свойства кислот
Опыт. Взаимодействие оксида меди(II) с серной кислотой. |
| Слайд №13 |
 |
Кислота + основнование = соль + вода
Химические свойства кислот
Опыт 1. Взаимодействие гидроксида калия с соляной кислотой.
Опыт 2. Взаимодействие гидроксида меди (II) с соляной кислотой.
|
| Слайд №14 |
 |
Кислота 1 + соль1 = соль2 + Кислота 2
Химические свойства кислот
Опыт 1. Взаимодействие хлорида бария с серной кислотой.
Опыт 2. Взаимодействие карбоната натрия с серной кислотой.
|
| Слайд №15 |
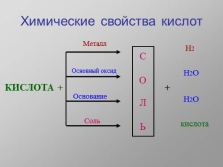 |
Химические свойства кислот
КИСЛОТА +
С
О
Л
Ь
Металл
Основный оксид
Основание
Соль
+
Н2
Н2О
Н2О
кислота |
| Слайд №16 |
 |
ФИЗПАУЗА |
| Слайд №17 |
 |
УЭ – 4
Цель. Проверить усвоение знаний по теме. |
| Слайд №18 |
 |
Задание.
Составьте возможные уравнения реакций перечисленных веществ с раствором серной кислоты.
I вариант – LiOH, SiO2
II вариант – Ba(NO3)2, Cu
III вариант – K2O, NaNO3
IV вариант – Mg, HCl
|
| Слайд №19 |
 |
2LiOH + H2SO4 = Li2SO4 + 2H2O (I вариант)
SiO2 + H2SO4 (реакция не идет) (I вариант)
Ba(NO3)2 + H2SO4 = BaSO4 + 2HNO3 (II вариант)
Cu + H2SO4 (реакция не идет) (II вариант)
K2O + H2SO4 = K2SO4 + 2H2O (III вариант)
NaNO3+ H2SO4 (реакция не идет) (III вариант)
Mg + H2SO4 = MgSO4 + H2? (IV вариант)
HCl + H2SO4 (реакция не идет) (IV вариант)
За каждый правильный ответ 1 балл.
Внесите заработанные баллы в листок учета знаний. |
| Слайд №20 |
 |
«5», если вы набрали 15 – 20 баллов
«4», если вы набрали 10 – 14 баллов
«3», если вы набрали 5 – 9 баллов
Поставь себе оценку: |
| Слайд №21 |
 |
Домашнее задание
§38 по учебнику Габриелян О.С. Химия 8 класс.
Творческое задание (по желанию) приготовить презентацию на тему: «Действие кислот на наш организм».
На оценку «5» — зад. 3,6,7,8 на стр.135-138 (рабочая тетрадь)
На оценку «4» — зад. 3, 6,7 на стр.135-138 (рабочая тетрадь)
На оценку «3» — зад. 3, 7 на стр.135-138 (рабочая тетрадь)
|
| Слайд №22 |
 |
Чем тебе понравился урок?
Что было сложного для тебя на этом уроке?
Что на уроке усвоено хорошо? |
Оцените статью:
(0 голосов, среднее: 0 из 5)
Поделитесь с друзьями!
Большой сборник презентаций в помощь школьнику.
закрыть
Скопируйте этот код и вставьте его на своем сайте:

