| Слайд №2 |
 |
Занимательные опыты
Обугливание сахара
Пламя-художник
«Вода» зажигает костер |
| Слайд №3 |
 |
Я растворю любой металл. Меня алхимик получал В реторте глиняной простой. Слыву я главной кислотой… Когда сама я растворяюсь В воде, то сильно нагреваюсь…
Серная кислота |
| Слайд №4 |
 |
«Сами, трудясь, Вы сделаете все для близких людей и для себя, а если при труде успеха не будет, неудача – не беда, попробуйте еще»
Менделеев Д.И. |
| Слайд №5 |
 |
Цель урока:
познакомиться с историей открытия серной кислоты и распространением ее в природе;
изучить химические и физические свойства серной кислоты;
дать представление о практическом значении серной кислоты в народном хозяйстве и жизни человека.
|
| Слайд №6 |
 |
Содержание
1. История открытия
2. Серная кислота в природе
3. Физические свойства
4. Химические свойства
а) разбавленная серная кислота
б) концентрированная серная кислота
5. Применение
6. Соли серной кислоты |
| Слайд №7 |
 |
Давайте вспомним:
1. Какие из приведенных формул веществ относятся к кислотам:
H2SiO3, NaOH, HCl, H2O, CO2, BaCl2, H2SO4
Дайте определение понятию «Кислоты».
2. Установите соответствие:
Формула кислот Название кислот
1. HNO3 1. Фосфорная
2. H2SO4 2. Азотная
3. H3PO4 3. Сернистая
4. H2SO3 4. Серная |
| Слайд №8 |
 |
3. В предложенных рядах исключите «лишнее вещество». Объясните свой выбор: а. NaOH, KOH, HCl; б. H2SO4, HCl, H2SiO3; в. HNO3, H2CO3, H2SO4.
4. С какими из перечисленных формул веществ взаимодействует раствор соляной кислоты:
Cu, KOH, CO2, Zn, CuO, AgNO3
|
| Слайд №9 |
 |
История открытия
1. Первое упоминание – алхимик Гебер
(при нагревании квасцов перегоняется
«спирт», обладающий сильной растворя-
ющей силой);
2. Средние века – получение серной кислоты основано на разложении сульфатов;
3. Андреас Либавий (16 век) – технический
способ получения серной кислоты;
4. 1746г (Англия) – первый камерный завод по получению серной кислоты;
1805г (Москва) – получение серной кислоты на заводе князя Голицына. |
| Слайд №10 |
 |
Серная кислота в природе
Кислотное озеро на глубине вулкана Малый Семячик
Кипящее озеро (Курильские острова)
Европа – спутник Юпитера
Облака планеты Венера |
| Слайд №11 |
 |
Физические свойства
H2SO4 — бесцветная маслянистая тяжелая жидкость, без запаха, нелетучая при н.у. Обладает сильным водоотнимающим свойством. Хорошо растворяется в воде.
Техника безопасности:
Кислоту приливают в воду осторожно, тоненькой струйкой. |
| Слайд №12 |
 |
Разбавление серной кислоты |
| Слайд №13 |
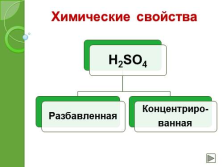 |
Химические свойства |
| Слайд №14 |
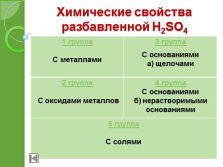 |
Химические свойства разбавленной H2SO4
1 группа
С металлами
3 группа
С основаниями
а) щелочами
2 группа
С оксидами металлов
4 группа
С основаниями
б) нерастворимыми основаниями
5 группа
С солями
5 группа
С солями
|
| Слайд №15 |
 |
Химические свойства разбавленной H2SO4
1. Взаимодействие с металлами
(Стоящими до Н в ЭРНМ)
Zn + H2SO4 = ZnSO4 + H2?
Zn0 — 2e- ? Zn+2 восстановитель
2Н+ +2e- ? H02 окислитель
Cu + H2SO4 ? |
| Слайд №16 |
 |
Химические свойства разбавленной H2SO4
2. Взаимодействие с основными и амфотерными оксидами
H2SO4 + CuO = CuSO4 + H2O
2H+ + SO42- + CuO = Cu2+ + SO42- + H2O
2H+ + CuO = Cu2+ + H2O
|
| Слайд №17 |
 |
Химические свойства разбавленной H2SO4
3. Взаимодействие с основаниями:
а) щелочами
H2SO4 + 2NaOH = Na2SO4 + 2H2O
2H+ + SO42- + 2Na+ + 2OH- = 2Na+ + SO42- + 2H2O
2H+ + 2OH- = 2H2O
H+ + OH- = H2O
б) нерастворимыми основаниями
H2SO4 + Cu(OH)2 = CuSO4 + 2H2O
2H+ + SO42- + Cu(OH)2 = Cu2+ + SO42- + 2H2O
Cu(OH)2 + 2H+ = Cu2+ + 2H2O
|
| Слайд №18 |
 |
Химические свойства разбавленной H2SO4
4. Взаимодействие с солями
H2SO4 + BaCl2 = BaSO4?+ 2HCl
2H+ + SO42- + Ba2+ + 2Cl- = BaSO4?+ 2H+ + 2Cl-
Ba2+ + SO42- = BaSO4?
Качественная реакция – выпадение белого осадка
белый
|
| Слайд №19 |
 |
Химические свойства концентрированной H2SO4
Концентрированная H2SO4 — сильный окислитель за счет S(+6)
1. Взаимодействие с металлами
H2SO4
+ активные металлы
+ малоактивные металлы
+ Fe, Al
H2S, S, SO2
SO2
Пассивация металла
Cu + 2H2SO4 (конц) = CuSO4 + SO2? + 2H2O
Cu0 – 2e-
Cu+2
S+6 + 2e-
S+4
окисление
восстановление
восстановитель
окислитель
|
| Слайд №20 |
 |
Взаимодействие концентрированной серной кислоты с металлами |
| Слайд №21 |
 |
Химические свойства концентрированной H2SO4
2. Взаимодействие с неметаллами
2H2SO4 + C = CO2 + 2SO2 + 2H2O
3. Взаимодействие с органическими веществами (гигроскопичность)
4. Взаимодействие с солями
H2SO4(конц) + NaCl(тв) = NaHSO4 + HCl?
|
| Слайд №22 |
 |
Гигроскопичность серной кислоты |
| Слайд №23 |
 |
Применение
H2SO4
HNO3
Производство кислот
Взрывчатые вещества
Электролитическая медь
Минеральные удобрения
Лекарства
Производство солей
Искусственный шелк
Очистка нефтепродуктов
Электролит в аккумуляторах
Производство эмали |
| Слайд №24 |
 |
Соли серной кислоты
Na2SO4? 10H2O
Глауберова соль
CaSO4?2H2O
Гипс
BaSO4
Сульфат бария
CuSO4?5H2O
Медный купорос |
| Слайд №25 |
 |
Тест
1. Концентрированная серная кислота при комнатной температуре не действует на каждое из двух веществ:
А) Mg, Cu; Б) Na, Zn; В) Ca, Li; Г) Fe, Al.
2. Разбавленная серная кислота реагирует с каждым из веществ:
А) Cu и KO H; Б) Na2CO3 и Al(OH)3
В) AlCl3 и Ag; Г) FeSO4 и H2SO4
3. При разбавлении серной кислоты всегда приливают кислоту к воде. Чем опасно разбавление концентрированной серной кислоты приливанием к ней воды?:
А) Может возникнуть пожар;
Б) Может произойти разложение воды;
В) Может выделиться ядовитое вещество;
Г) Может произойти разбрызгивание раствора вследствие выделения теплоты.
4. Водный раствор серной кислоты реагирует с каждым из веществ:
А) С цинком и оксидом натрия;
Б) С железом и оксидом углерода (II);
В) С алюминием и хлоридом натрия;
Г) С медью и гидроксидом калия.
|
| Слайд №26 |
 |
Тест (ответы)
1 – Г
2 – Б
3 – Г
4 – А |
| Слайд №27 |
 |
Продолжите предложение
Сегодня я узнал (а)……………..
Было интересно…………………
Меня удивило……………………
Я научился (лась)……………….
Я выполнял (а) задания… ……
Мне захотелось…………………..
|
| Слайд №28 |
 |
Домашнее задание
Параграф 27 (с. 197-202).
Выполнение домашнего задания по уровням:
«3» — с. 204 № 8;
«4» — с. 204 № 3;
«5» — с. 204 № 7.
|
| Слайд №29 |
 |
Список литературы
1. Габриелян О.С. Химия. 9 класс. – М.: Дрофа, 2013. – 319с.
2. http://www.himtrade.ru/info/st43.htm
3.
http://sigmatec.ru/main/prod/sernaya_kislota/nature
4.
http://ru.wikipedia.org/wiki/%D1%F3%EB%FC%F4%E0%F2%FB
5. http://www.newchemistry.ru/printletter.php?n_id=7508
|

