| Слайд №2 |
 |
ХРОМ |
| Слайд №3 |
 |
I. Исторические сведения
II. Хром – химический элемент:
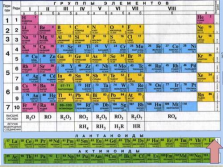
1.Положение хрома в периодической системе
химических элементов Д.И.Менделеева
2. Строение атома.
III.Хром – простое вещество
3. Нахождение в природе
1. Состав. Физические свойства.
2. Получение.
3. Химические свойства
4. Биологическая роль и физиологическое действие.
5. Применение
IV. Соединения хрома |
| Слайд №4 |
 |
В 1766 году в окрестностях Екатеринбурга был обнаружен минерал, который получил название «сибирский красный свинец», PbCrO4. Современное название — крокоит.
В 1797 французский химик Л. Н. Воклен открыл в сибирской
красной свинцовой руде новый элемент хром и в 1798 году
получил его в свободном состоянии.
Происхождение названия
Название элемент получил от греч. ????? — цвет, краска — из-за разнообразия окраски своих соединений. |
| Слайд №5 |
 |
Французский химик Луи Николя Воклен родился в Сент-Андре-д’Эберто (Нормандия). Совместно с А. Ф. Фуркруа выяснил (1799) химическую природу мочевины. Совместно с П. Ж. Робике открыл (1806) первую аминокислоту аспарагин. Открыл также пектин и яблочную кислоту, выделил камфорную и хинную кислоты.
Внёс существенный вклад в развитие анализа минералов. Создал школу химиков. Опубликовал одно из первых в мире руководств по химическому анализу – «Введение в аналитическую химию» (1799).
|
| Слайд №6 |
 |
|
| Слайд №7 |
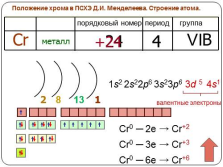 |
Положение хрома в ПСХЭ Д.И. Менделеева. Строение атома.
период
группа
порядковый номер
Cr
металл
24
4
VIB
+24
4
2
1
8
валентные электроны
13
1s2
2s22p6
4s1
3s23p6
3d 5
Cr0 ? 2e ? Cr+2
Cr0 ? 3e ? Cr+3
Cr0 ? 6e ? Cr+6 |
| Слайд №8 |
 |
Нахождение хрома в природе
Хром является довольно распространённым элементом (0,02 масс. долей, %). Основные соединения хрома — хромистый железняк (хромит) FeO·Cr2O3. Вторым по значимости минералом является крокоит PbCrO4.
хромит
крокоит |
| Слайд №9 |
 |
Физические свойства
Плотность 7,19 г/см3;
t плавления 1890°С;
t кипения 2480°С.
В свободном виде — голубовато- белый металл.
Хром (с примесями) является одним из самых твердых металлов.
Очень чистый хром достаточно хорошо поддаётся механической обработке, пластичен.
Устойчив на воздухе. При 2000 °C сгорает с образованием зелёного оксида хрома (III) Cr2O3. |
| Слайд №10 |
 |
Получение
Из хромистого железняка Fe(CrO2)2 (хромита железа) получают феррохром восстановлением в электропечах коксом (углеродом):
FeO· Cr2O3 + 4C ? Fe + 2Cr + 4CO?
Феррохром — сплав железа и хрома (около 60% ),
основные примеси – углерод (до5%) кремний (до 8%), сера (до 0,05 %),
фосфор (до 0,05 %).
Феррохром применяют для производства легированных
сталей. |
| Слайд №11 |
 |
Чтобы получить чистый хром, реакцию ведут следующим образом:
1) сплавляют хромит железа с карбонатом натрия (кальцинированная сода) на воздухе:
4Fe(CrO2)2 + 8Na2CO3 + 7O2 ? 8Na2CrO4 + 2Fe2O3 + 8CO2?
2) растворяют хромат натрия и отделяют его от оксида железа;
3) переводят хромат в дихромат, подкисляя раствор и выкристаллизовывая дихромат;
4) получают чистый оксид хрома восстановлением дихромата углём:
Na2Cr2O7 + 2C ? Cr2O3 + Na2CO3 + CO?
5) с помощью алюминотермии получают металлический хром:
Cr2O3 + 2Al ? Al2O3 + 2Cr + 130 ккал |
| Слайд №12 |
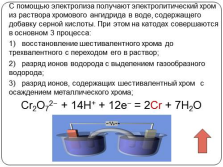 |
С помощью электролиза получают электролитический хром из раствора хромового ангидрида в воде, содержащего добавку серной кислоты. При этом на катодах совершаются в основном 3 процесса:
1) восстановление шестивалентного хрома до трехвалентного с переходом его в раствор;
2) разряд ионов водорода с выделением газообразного водорода;
3) разряд ионов, содержащих шестивалентный хром с осаждением металлического хрома;
Cr2O72? + 14Н+ + 12е? = 2Cr + 7H2O |
| Слайд №13 |
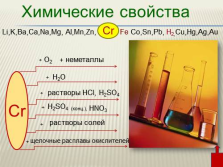 |
Химические свойства
Li,K,Ba,Ca,Na,Mg, Al,Mn,Zn, Fe Co,Sn,Pb, H2,Cu,Hg,Ag,Au
Cr
Cr
+
+
+
+
H2SO4 (конц.),
растворы солей
+ неметаллы
О2
растворы HCl, H2SO4
H2O
+
щелочные расплавы окислителей
+
HNO3 |
| Слайд №14 |
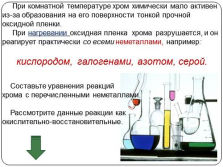 |
При комнатной температуре хром химически мало активен
из-за образования на его поверхности тонкой прочной
оксидной пленки.
При нагревании оксидная пленка хрома разрушается, и он реагирует практически со всеми неметаллами, например:
кислородом, галогенами, азотом, серой.
Составьте уравнения реакций
хрома с перечисленными неметаллами.
Рассмотрите данные реакции как
окислительно-восстановительные. |
| Слайд №15 |
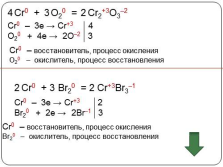 |
Cr0 + O20 = Cr2+3O3–2
4
2
3
Cr0 – 3e ? Cr+3 4
O20 + 4e ? 2O–2 3
Cr0 – восстановитель, процесс окисления
O20 – окислитель, процесс восстановления
Cr0 + Br20 = Cr+3Br3–1
2
3
2
Cr0 – 3e ? Cr+3 2
Br20 + 2e ? 2Br–1 3
Cr0 – восстановитель, процесс окисления
Br20 – окислитель, процесс восстановления |
| Слайд №16 |
 |
Cr0 + N20 = Cr+3N–3
Cr0 – 3e ? Cr+3 2
N20 + 6e ? 2N–3 1
2
2
Cr0 – восстановитель, процесс окисления
N20 – окислитель, процесс восстановления
Cr0 + S0 = Cr2+3S3–2
Cr0 – 3e ? Cr+3 2
S0 + 2e ? S–2 3
2
3
Cr0 – восстановитель, процесс окисления
S0 – окислитель, процесс восстановления |
| Слайд №17 |
 |
В раскаленном состоянии хром реагирует с парами воды:
2Cr + 3H2O = Cr2O3 + 3H2
Li,K,Ba,Ca,Na,Mg, Al,Mn,Zn, Fe Co,Sn,Pb, H2,Cu,Hg,Ag,Au
Cr
В ряду напряжений хром находится левее водорода и поэтому
в отсутствии воздуха может вытеснять водород из растворов
соляной и серной кислот, образуя соли хрома (II).
Составьте уравнения реакций хрома c растворами соляной и серной кислот.
Рассмотрите данные реакции как окислительно-восстановительные. |
| Слайд №18 |
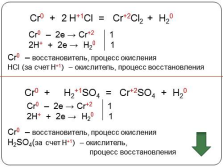 |
Cr0 + H+1Cl = Cr+2Cl2 + H20
Cr0 – 2e ? Cr+2 1
2H+ + 2e ? H20 1
2
Cr0 – восстановитель, процесс окисления
HCl (за счет Н+1) – окислитель, процесс восстановления
Cr0 + H2+1SO4 = Cr+2SO4 + H20
Cr0 – 2e ? Cr+2 1
2H+ + 2e ? H20 1
Cr0 – восстановитель, процесс окисления
H2SO4(за счет Н+1) – окислитель,
процесс восстановления |
| Слайд №19 |
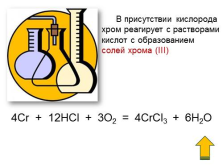 |
В присутствии кислорода
хром реагирует с растворами
кислот c образованием
солей хрома (III)
4Cr + 12HCl + 3O2 = 4CrCl3 + 6H2O |
| Слайд №20 |
 |
Концентрированные серная и азотная
кислоты на холоду пассивируют хром
При сильном нагревании кислоты
pастворяют хром с образованием
cолей хрома (III)
Cr + H2SO4 ? Cr2(SO4)3 + SO2 + H2O
Cr + HNO3 ? Cr(NO3)3 + NO2 + H2O
Рассмотрите эти реакции как окислительно-восстановительные
Расставьте коэффициенты.
Назовите окислитель и восстановитель. |
| Слайд №21 |
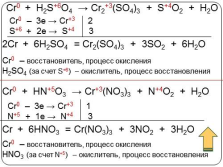 |
Cr0 + H2S+6O4 ? Cr2+3(SO4)3 + S+4O2 + H2O
Cr0 + HN+5O3 ? Cr+3(NO3)3 + N+4O2 + H2O
Cr0 – 3e ? Cr+3 2
S+6 + 2e ? S+4 3
2Cr + 6H2SO4 = Cr2(SO4)3 + 3SO2 + 6H2O
Cr0 – восстановитель, процесс окисления
H2SO4 (за счет S+6) – окислитель, процесс восстановления
Cr0 – 3e ? Cr+3 1
N+5 + 1e ? N+4 3
Cr + 6HNO3 = Cr(NO3)3 + 3NO2 + 3H2O
Cr0 – восстановитель, процесс окисления
HNO3 (за счет N+5) – окислитель, процесс восстановления |
| Слайд №22 |
 |
Хром способен вытеснять многие металлы, например
медь, олово, серебро и другие, из растворов их солей:
Cr0 + Cu+2SO4 ? Cr+2SO4 + Cu0
Составьте уравнение реакции хрома c раствором сульфата
меди (II). Рассмотрите данную реакцию как окислительно-восстановительную.
Cr0 – 2e ? Cr+2 1
Cu+2+ 2e ? Cu0 1
Cr + CuSO4 = CrSO4 + Cu
Cr0 – восстановитель, процесс окисления
CuSO4 (за счет Cu+2) – окислитель, процесс
восстановления |
| Слайд №23 |
 |
Cr + KClO3 + KOH K2CrO4 + KCl + H2O
Рассмотрите эту реакцию как окислительно-восстановительную
Расставьте коэффициенты.
Назовите окислитель и восстановитель.
Растворы щелочей на хром практически не действуют.
Хром реагирует с щелочными расплавами окислителей.
В качестве окислителей используют нитраты натрия, калия,
хлорат калия и другие окислители.
При взаимодействии с щелочными расплавами окислителей
хром образует соли анионного типа, в которых проявляет
высшую степень окисления.
сплавление |
| Слайд №24 |
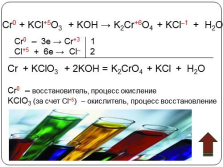 |
Cr0 + KCl+5O3 + KOH ? K2Cr+6O4 + KCl–1 + H2O
Cr0 – 3e ? Cr+3 1
Cl+5 + 6e ? Cl– 2
Cr + KClO3 + 2KOH = K2CrO4 + KCl + H2O
Cr0 – восстановитель, процесс окисление
KClO3 (за счет Cl+5) – окислитель, процесс восстановление |
| Слайд №25 |
 |
Хром — постоянная составная часть растительных и животных организмов. В крови содержится от 0,012 до 0,0035 % хрома. Хром имеет большое значение в метаболизме углеводов и жиров, а также участвует в процессе синтеза инсулина. Важнейшая его биологическая роль состоит в регуляции углеводного обмена и уровня глюкозы в крови Элемент способствует нормальному формированию и росту детского организма. Снижение содержания хрома в пище и крови приводит к уменьшению скорости роста, увеличению холестерина в крови.
|
| Слайд №26 |
 |
Хром важный компонент во многих легированных сталях.
Используется в качестве износоустойчивых и красивых
гальванических покрытий (хромирование)
Хром применяется для производства сплавов:
хром-30 и хром-90, незаменимых для производства сопел
мощных плазмотронов и в авиакосмической промышленности. |
| Слайд №27 |
 |
Соединения хрома
Соединения хрома (II)
Соединения хрома (III)
Соединения хрома (VI)
оксид
гидроксид
соли
оксид
гидроксид
соли
соли
гидроксид
оксид |
| Слайд №28 |
 |
Соединения хрома (II)
CrO
Оксид хрома (II) – кристаллы черного цвета,
имеет основный характер
При осторожном нагревании
гидроксида хрома (II) в отсутствии кислорода получают оксид хрома (II). Составьте уравнение реакции.
Cr(OH)2 = CrO + H2O
3CrO = Cr + Cr2O3
При более высоких температурах оксид хрома (II)
диспропорционирует:
700° |
| Слайд №29 |
 |
Составьте уравнение реакции оксида хрома (II) с соляной и
серной кислотами. Рассмотрите реакции с точки зрения ТЕД.
CrO + H2SO4 = CrSO4 + H2O
CrO + 2H+ + Cl– = Cr2+ + 2Cl– + H2O
CrO + 2H+ = Cr2+ + H2O
CrO + 2HCl = CrCl2 + H2O
CrO + 2H+ + SO42– = Cr2+ + SO42– + H2O
CrO + 2H+ = Cr2+ + H2O |
| Слайд №30 |
 |
Оксид хрома (II) – сильный восстановитель.
Кислородом воздуха окисляется до оксида
хрома (III)
Составьте уравнение реакции.
Рассмотрите данную реакцию
как окислительно-восстановительную.
Cr+2O + O20 ? Cr2+3O3–2
Cr+2 – 1e ? Cr+3 4
O20 + 4e ? 2O–2 1
4CrO + O2 = 2Cr2O3
CrO (за счет Cr+2) – восстановитель, процесс окисления
O2 – окислитель, процесс восстановления |
| Слайд №31 |
 |
Cr(OH)2
Гидроксид хрома (II)
Гидроксид хрома (II) получают в виде желтого осадка действием растворов щелочей на соли хрома (II) без доступа воздуха.
Составьте уравнение реакции получения гидроксида хрома (II) действием гидроксида натрия на хлорид хрома (II). Рассмотрите реакцию с точки зрения ТЕД.
CrCl2 + 2NaOH = Cr(OH)2 ? + 2NaCl
Cr2+ + 2Cl– + 2Na+ + 2OH– = Cr(OH)2 ? + 2Na+ + 2Cl–
Cr2+ + 2OH– = Cr(OH)2 ? |
| Слайд №32 |
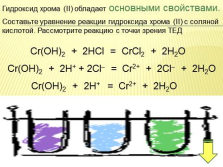 |
Гидроксид хрома (II) обладает основными свойствами.
Составьте уравнение реакции гидроксида хрома (II) с соляной
кислотой. Рассмотрите реакцию с точки зрения ТЕД
Cr(OН)2 + 2HCl = CrCl2 + 2H2O
Cr(OН)2 + 2H+ + 2Cl– = Cr2+ + 2Cl– + 2H2O
Cr(OН)2 + 2H+ = Cr2+ + 2H2O |
| Слайд №33 |
 |
Гидроксид хрома (II) – сильный восстановитель.
Кислородом воздуха окисляется до гидроксида хрома (III)
Составьте уравнение реакции. Рассмотрите данную реакцию
как окислительно-восстановительную.
Cr+2(ОН)2+ O20 + Н2О ? Cr+3(O –2Н)3
Cr+2 – 1e ? Cr+3 4
O20 + 4e ? 2O–2 1
4Cr(OН)2 + O2 + 2Н2О = 4Cr(OН)3
Cr(OН)2 (за счет Cr+2) –восстановитель, процесс окисления
O2 – окислитель, процесс восстановления |
| Слайд №34 |
 |
Соли хрома (II)
Водные растворы солей хрома (II) получают без доступа
воздуха растворением металлического хрома в разбавленных
кислотах в атмосфере водорода или восстановлением цинком
в кислой среде солей трехвалентного хрома.
Безводные соли хрома (II) белого цвета, а водные растворы и
кристаллогидраты — синего цвета.
Соединения хрома (II) – сильные восстановители. Легко окисляются. Именно поэтому очень трудно получать и хранить соединения двухвалентного хрома.
Реагируют с концентрированными серной и азотной кислотами:
CrCl2 + O2 + HCl ? CrCl3 + H2O
CrCl2 + H2SO4 ? Cr2(SO4)3 + SO2? + HCl? + H2O
CrCl2 + HNO3 ? Cr(NO3)3 + NO2? + HCl? + H2O
Рассмотрите эти реакции как окислительно-
восстановительные. Расставьте коэффициенты.. |
| Слайд №35 |
 |
Cr+2Cl2 + O20 + HCl ? Cr+3Cl3 + H2O–2
Cr+2 – 1e ? Cr+3 4
O20 + 4e ? 2O–2 1
4CrCl2 + O2 + 4HCl = 4CrCl3 + 2H2O |
| Слайд №36 |
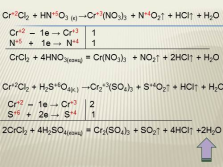 |
Cr+2Cl2 + HN+5O3 (к) ?Cr+3(NO3)3 + N+4O2? + HCl? + H2O
Cr+2 – 1e ? Cr+3 1
N+5 + 1e ? N+4 1
CrCl2 + 4HNO3(конц) = Cr(NO3)3 + NO2? + 2HCl? + H2O
Cr+2Cl2 + H2S+6O4(к.) ?Cr2+3(SO4)3 + S+4O2? + HCl? + H2O
Cr+2 – 1e ? Cr+3 2
S+6 + 2e ? S+4 1
2CrCl2 + 4H2SO4(конц) = Cr2(SO4)3 + SO2? + 4HCl? +2H2O |
| Слайд №37 |
 |
Соединения хрома (III)
Cr2O3
Оксид хрома () – тугоплавкий порошок темно-зеленого цвета.
Получение.
В лабораторных условиях термическим разложением
дихромата аммония:
(NH4)2Cr2O7 = Cr2O3 + N2 + 2H2O
В промышленности восстановлением дихромата калия
коксом или серой:
K2Cr2O7 + 3C = 2Cr2O3 + 2K2CO3 + CO2
K2Cr2O7 + S = 2Cr2O3 + K2SO4
t°
t°
t° |
| Слайд №38 |
 |
Оксид хрома (III) обладает амфотерными свойствами
При взаимодействии с кислотами образуются соли хрома (III):
Составьте уравнение реакции оксида хрома (III) с соляной
кислотой. Рассмотрите реакцию с точки зрения ТЕД.
Cr2O3 + 6HCl = 2CrCl3 + 3H2O
Cr2O3 + 6H+ + 6Cl– = 2Cr3+ + 6Cl– + 3H2O
Cr2O3 + 6H+ = 2Cr3+ + 3H2O |
| Слайд №39 |
 |
При сплавлении оксида хрома (III) с оксидами,
гидроксидами и карбонатами щелочных и
щелочноземельных металлов образуются
хроматы (III) (хромиты):
Сr2O3 + Ba(OH)2 = Ba(CrO2)2 + H2O
Сr2O3 + Na2CO3 = 2NaCrO2 + CO2
t°
t°
Оксид хрома (III) нерастворим в воде. |
| Слайд №40 |
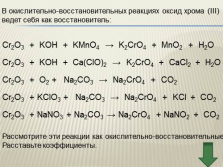 |
В окислительно-восстановительных реакциях оксид хрома (III)
ведет себя как восстановитель:
Cr2O3 + KOH + KMnO4 ? K2CrO4 + MnO2 + H2O
Рассмотрите эти реакции как окислительно-восстановительные
Расставьте коэффициенты.
Cr2O3 + KOH + Сa(ClO)2 ? K2CrO4 + CaCl2 + H2O
Cr2O3 + O2 + Na2CO3 ? Na2CrO4 + CO2
Cr2O3 + KClO3 + Na2CO3 ? Na2CrO4 + KCl + CO2
Cr2O3 + NaNO3 + Na2CO3 ? Na2CrO4 + NaNO2 + CO2 |
| Слайд №41 |
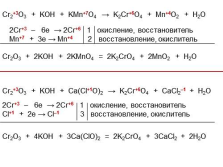 |
Cr2+3O3 + KOH + KMn+7O4 ? K2Cr+6O4 + Mn+4O2 + H2O
2Cr+3 – 6e ? 2Cr+6 1 окисление, восстановитель
Mn+7 + 3e ? Mn+4 2 восстановление, окислитель
Cr2O3 + 2KOH + 2KMnO4 = 2K2CrO4 + 2MnO2 + H2O
Cr2+3O3 + KOH + Сa(Cl+1O)2 ? K2Cr+6O4 + CaCl2–1 + H2O
2Cr+3 – 6e ? 2Cr+6 1 окисление, восстановитель
Cl+1 + 2e ? Cl–1 3 восстановление, окислитель
Cr2O3 + 4KOH + 3Сa(ClO)2 = 2K2CrO4 + 3CaCl2 + 2H2O |
| Слайд №42 |
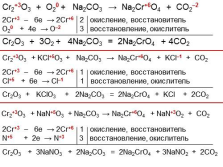 |
Cr2+3O3 + O20 + Na2CO3 ? Na2Cr+6O4 + CO2–2
2Cr+3 – 6e ? 2Cr+6 2 окисление, восстановитель
O20 + 4e ? O–2 3 восстановление, окислитель
Cr2O3 + 3O2 + 4Na2CO3 = 2Na2CrO4 + 4CO2
Cr2+3O3 + KCl+5O3 + Na2CO3 ? Na2Cr+6O4 + KCl–1 + CO2
2Cr+3 – 6e ? 2Cr+6 1 окисление, восстановитель
Cl+5 + 6e ? Cl–1 1 восстановление, окислитель
Cr2O3 + KClO3 + 2Na2CO3 = 2Na2CrO4 + KCl + 2CO2
Cr2+3O3 + NaN+5O3 + Na2CO3 ? Na2Cr+6O4 + NaN+3O2 + CO2
2Cr+3 – 6e ? 2Cr+6 1 окисление, восстановитель
N+5 + 2e ? N+3 3 восстановление, окислитель
Cr2O3 + 3NaNO3 + 2Na2CO3 = 2Na2CrO4 + 3NaNO2 + 2CO2 |
| Слайд №43 |
 |
Оксид хрома (III) – катализатор
В присутствии оксида хрома (III) аммиак окисляется кислородом воздуха до монооксида азота, который в избытке кислорода окисляется до бурого диоксида азота.
|
| Слайд №44 |
 |
Каталитическое окисление этанола
Окисление этилового спирта кислородом воздуха происходит очень легко в присутствии оксида хрома (III)
Реакция окисления спирта протекает с выделением энергии. Продукт реакции окисления спирта — уксусный альдегид.
Cr2O3, t°
2СН3–СН2–ОН + О2 2СН3 – С ? О + 2H2O
H |
| Слайд №45 |
 |
Гидроксид хрома (III)
Cr(OH)3
Получают гидроксид хрома (III) действием
растворов щелочей или аммиака на растворы
солей хрома (III).
Составьте уравнение реакции получения
Cr(OH)3 действием раствора аммиака на
хлорид хрома (III):
CrCl3 + 3(NH3·H2O) = Cr(OH)3 + 3NH4Cl
Лабораторный опыт № 1
К раствору хлорида хрома (III) прилейте раствор
аммиака. Что наблюдаете? |
| Слайд №46 |
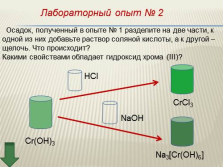 |
Лабораторный опыт № 2
Осадок, полученный в опыте № 1 разделите на две части, к
одной из них добавьте раствор соляной кислоты, а к другой –
щелочь. Что происходит?
Какими свойствами обладает гидроксид хрома (III)?
Cr(OH)3
CrCl3
Na3[Cr(OH)6]
NaOH
HCl |
| Слайд №47 |
 |
+H2SO4
+NaOH
Осадок, полученный в опыте № 1 разделите на две части, к
одной из них добавьте серной кислоты, а к другой – щелочь.
Что происходит? |
| Слайд №48 |
 |
Гидроксид хрома (III) обладает амфотерными свойствами.
При взаимодействии с кислотами образуются соли хрома (III):
Составьте уравнение реакции гидроксида хрома (III) с соляной
кислотой. Рассмотрите реакцию с точки зрения ТЕД.
Cr(OH)3 + 3HCl = CrCl3 + 3H2O
Cr(OH)3 + 3H+ + 3Cl– = Cr3+ + 3Cl– + 3H2O
Cr(OH)3 + 3H+ = Cr3+ + 3H2O |
| Слайд №49 |
 |
Cr(OH)3 + 3NaOH = Na3[Cr(OH)6]
Cr(OH)3 + 3Na+ + 3OH– = 3Na+ + [Cr(OH)6]3–
Cr(OH)3 + 3OH– = [Cr(OH)6]3–
2Cr(OH)3 = Cr2O3 + 3H2O
t°
Гидроксид хрома (III) растворяется в щелочах
При нагревании гидроксид хрома (III) разлагается:
гексагидроксохромат (III) натрия
(изумрудно-зеленый) |
| Слайд №50 |
 |
Соли хрома (III)
Хроматы (III) устойчивы в щелочной среде. Они легко реагируют с кислотами:
недостаток кислоты:
избыток кислоты:
В растворе подвергаются полному гидролизу:
NaCrO2 + HCl + H2O = Cr(OH)3 + NaCl
NaCrO2 + 4HCl = CrCl3 + NaCl + 2H2O
с угольной кислотой
Na3[Cr(OH)6] + 3CO2 = Cr(OH)3 + 3NaHCO3
Cr2S3 + 6H2O = 2Cr(OH)3 + 3H2S
В водных растворах катион Cr3+ встречается только
в виде гидратированного иона [Cr(H2O)6] 3+, который
придает раствору сине-фиолетовый цвет.
раствору сине-фиолетовый цвет. |
| Слайд №51 |
 |
Сульфат хрома (III) образует двойные соли – хромовые квасцы.
Из смешанного раствора сульфата хрома (III) и сульфата калия
кристаллизуется двойная соль – KCr(SO4)2·12H2O
сине-фиолетового цвета.
Применяются в качестве дубящего вещества при
изготовлении эмульсий, а также в дубящих растворах
и дубящих фиксажах. |
| Слайд №52 |
 |
Соединения хрома (III) могут проявлять как окислительные
так и восстановительные свойства.
Рассмотрите эти реакции как окислительно-восстановительные
Расставьте коэффициенты.
Назовите окислитель и восстановитель.
K3[Cr(OH)6] + Br2 + KOH ? K2CrO4 + KBr + H2O
CrCl3 + H2O2 + KOH ? K2CrO4 + KCl + H2O
KCrO2 + PbO2 + KOH ? K2CrO4 + K2PbO2 + H2O
Cr2(SO4)3 + Cl2 + NaOH ? Na2CrO4 + NaCl + H2O + Na2SO4
CrCl3 + Zn ? CrCl2 + ZnCl2 |
| Слайд №53 |
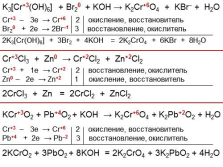 |
K3[Cr+3(OH)6] + Br20 + KOH ? K2Cr+6O4 + KBr– + H2O
Cr+3 – 3e ? Cr+6 2 окисление, восстановитель
Br20 + 2e ? 2Br–1 3 восстановление, окислитель
2K3[Cr(OH)6] + 3Br2 + 4KOH = 2K2CrO4 + 6KBr + 8H2O
Cr+3Cl3 + Zn0 ? Cr+2Cl2 + Zn+2Cl2
Cr+3 + 1e ? Cr+2 2 восстановление, окислитель
Zn0 – 2e ? Zn+2 1 окисление, восстановитель
2CrCl3 + Zn = 2CrCl2 + ZnCl2
KCr+3O2 + Pb+4O2 + KOH ? K2Cr+6O4 + K2Pb+2O2 + H2O
Cr+3 – 3e ? Cr+6 2 окисление, восстановитель
Pb+4 + 2e ? Pb–2 3 восстановление, окислитель
2KCrO2 + 3PbO2 + 8KOH = 2K2CrO4 + 3K2PbO2 + 4H2O |
| Слайд №54 |
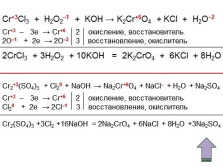 |
Cr+3Cl3 + H2O2–1 + KOH ? K2Cr+6O4 + KCl + H2O–2
Cr+3 – 3e ? Cr+6 2 окисление, восстановитель
2O–1 + 2e ? 2O–2 3 восстановление, окислитель
2CrCl3 + 3H2O2 + 10KOH = 2K2CrO4 + 6KCl + 8H2O
Cr2+3(SO4)3 + Cl20 + NaOH ? Na2Cr+6O4 + NaCl– + H2O + Na2SO4
Cr+3 – 3e ? Cr+6 2 окисление, восстановитель
Cl20 + 2e ? 2Cl–1 3 восстановление, окислитель
Cr2(SO4)3 +3Cl2 +16NaOH = 2Na2CrO4 + 6NaCl + 8H2O +3Na2SO4 |
| Слайд №55 |
 |
Получают CrO3 действием избытка
концентрированной серной кислоты
на насыщенный водный раствор
дихромата натрия:
Na2Cr2O7 + 2H2SO4 = 2CrO3 + 2NaHSO4 + H2O
Оксид хрома (VI) очень ядовит.
4CrO3 ? 2Cr2O3 + 3O2?.
При нагревании выше 250 °C разлагается:
Оксид хрома (VI) CrO3 — хромовый ангидрид,
представляет собой темно-красные
игольчатые кристаллы. |
| Слайд №56 |
 |
CrO3 — кислотный оксид.
С избытком воды образуется хромовая
кислота H2CrO4
CrO3 + Н2O = Н2CrO4
При большой концентрации CrO3 образуется дихромовая
кислота Н2Cr2О7
2CrO3 + Н2O = Н2Cr2O7
которая при разбавлении переходит в хромовую кислоту:
Н2Cr2О7 + Н2О = 2Н2CrO4
При растворении в воде образует кислоты.
Эти кислоты – неустойчивые. Существуют только в растворе.
Между ними в растворе устанавливается равновесие
2Н2CrO4 ? Н2Cr2O7 + Н2O
При взаимодействии CrO3 со щелочами образуются хроматы
CrO3 + 2KOH ? K2CrO4 + H2O. |
| Слайд №57 |
 |
CrO3 является сильным окислителем
Например этанол, ацетон и многие другие органические вещества самовоспламеняются или даже взрываются при контакте с ним.
Окисляет йод, серу, фосфор, уголь.
4CrO3 + 3S = 2Cr2O3 + 3SO2?.
CrO3 + C2H5OH ? CO2 + Cr2O3 + H2O
C2H5OH + 3H2O – 12e ? 2CO2 + 12H+ 1
2CrO3 + 6H+ + 6e ? Cr2O3 + 3H2O 2
4CrO3 + C2H5OH ? 2CO2 + 2Cr2O3 + 3H2O
C2H5OH + 3H2O + 4CrO3 + 12H+ = 2CO2 + 12H+ + 2Cr2O3 + 6H2O |
| Слайд №58 |
 |
Если поместить оксид хрома на фарфоровую пластинку и капнуть на него несколько капель ацетона,то через несколько секунд ацетон загорается. При этом оксид хрома (VI) восстанавливается до оксида хрома (III), а ацетон окисляется до углекислого газа и воды.
Окисление ацетона хромовым ангидридом.
16CrO3 + 3CH3– С – CH3 ? 9CO2 + 8Cr2O3 + 9H2O
О |
| Слайд №59 |
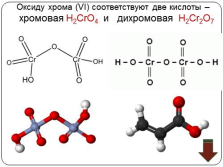 |
Оксиду хрома (VI) соответствуют две кислоты –
хромовая Н2CrO4 и дихромовая Н2Cr2O7 |
| Слайд №60 |
 |
Хромовая кислота — кристаллическое вещество красного цвета; выделена в свободном состоянии при охлаждении насыщенных водных растворов CrO3; хромовая кислота — электролит средней силы. Изополихромовые кислоты существуют в водных растворах, окрашенных в красный цвет |
| Слайд №61 |
 |
хроматы – соли хромовой кислоты устойчивы в щелочной среде, при
подкислении переходят в оранжевые
дихроматы, соли двухромовой кислоты. Реакция обратима, поэтому при добавлении щелочи желтая окраска хромата восстанавливается.
2CrO42– + 2H+ ? Cr2O72– + H2O
хроматы
дихроматы
соли
ОН–
Н+ |
| Слайд №62 |
 |
Лабораторный опыт № 3
К раствору дихромата калия добавьте гидроксид калия.
Как изменилась окраска? Чем это вызвано?
К полученному раствору добавьте
серной кислоты до восстановления
желтой окраски.
Напишите уравнения реакций. |
| Слайд №63 |
 |
2K2CrO4 + H2SO4(разб.) = K2Cr2O7 + K2SO4 + H2O
K2Cr2O7 + 2KOH = 2K2CrO4 + H2O
2K2CrO4 + 2HCl(разб.) = K2Cr2O7 + 2KCl + H2O
2K2CrO4 + H2O + CO2 = K2Cr2O7 + KHCO3 |
| Слайд №64 |
 |
Взаимопревращение хроматов и дихроматов
Оксиду хрома (VI) соответствуют две кислоты – хромовая Н2CrO4 и дихромовая Н2Cr2O7, Хромат калия K2CrO4 и дихромат калия K2Cr2O7 – соли этих кислот. Хроматы – желтого цвета, дихроматы – оранжевого. В кислой среде хромат-ион превращается в дихромат-ион. В присутствии щелочи дихроматы снова становятся хроматами. Хромат калия превращаем в дихромат, добавляя кислоту. Желтый раствор становится оранжевым.
2K2CrO4 + H2SO4 = K2Cr2O7 + K2SO4 + H2O
В стакан с дихроматом калия добавляем щелочь, оранжевый раствор становится желтым – дихроматы превращаются в хроматы.
K2Cr2O7 + 2KOH = 2K2CrO4 + H2O
|
| Слайд №65 |
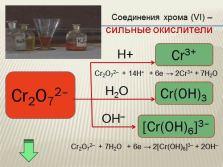 |
Соединения хрома (VI) –
сильные окислители
Cr2O72–
Cr3+
Cr(OH)3
[Cr(OH)6]3–
H+
H2O
OH–
Cr2O72– + 14H+ + 6e ? 2Cr3+ + 7H2O
Cr2O72– + 7Н2О + 6e ? 2[Cr(OH)6]3– + 2ОН– |
| Слайд №66 |
 |
Окислительные свойства дихроматов
Дихроматы, например дихромат калия K2Cr2O7 – сильные окислители. Под действием восстановителей дихроматы в кислой среде переходят в соли хрома (III). Примером такой реакции может служить окисление сульфита натрия раствором дихромата калия в кислой среде. К раствору дихромата калия добавляем серную кислоту и раствор сульфита натрия.
K2Cr2O7 +3Na2SO3+4H2SO4 =Cr2(SO4)3 + 3Na2SO4+ K2SO4 + 4H2O
Оранжевая окраска, характерная для дихроматов, переходит в зеленую. Образовался раствор сульфата хрома (III) зеленого цвета. Соли хрома — ярко окрашены, именно поэтому элемент получил такое название: «хром», что в переводе с греческого означает «цвет, краска».
опыт |
| Слайд №67 |
 |
Zn + K2Cr2O7 + H2SO4 ? ZnSO4 + Cr2(SO4)3 + K2SO4 +H2O
K2Cr2O7 + H2S + H2SO4 ? S + Cr2(SO4)3 + K2SO4 +H2O
K2Cr2O7 + H2O2 + H2SO4 ? O2 + Cr2(SO4)3 + K2SO4 +H2O
K2Cr2O7 + H2O + H2S ? S + Cr(OH)3 + KOH
K2Cr2O7 + H2O + K2S ? S + K3[Cr(OH)6] + KOH
Дихроматы проявляют окислительные свойства не только в
растворах, но и в твердом виде:
K2Cr2O7 + S ? K2SO4 + Cr2O3
K2Cr2O7 + С ? K2СO3 + СО + Cr2O3
K2Cr2O7 + Al ? Cr + KAlO2 + Al2O3
Рассмотрите эти реакции как окислительно-восстановительные
Расставьте коэффициенты.
K2Cr2O7 + KOH + (NH4)2S ? S + K3[Cr(OH)6] + NH3 |
| Слайд №68 |
 |
Zn0 + K2Cr2+6O7 + H2SO4 ? Zn+2SO4 + Cr2+3(SO4)3 + K2SO4 +H2O
Cr+6 + 3e ? Cr+3 2 восстановление, окислитель
Zn0 – 2e ? Zn+2 3 окисление, восстановитель
3Zn + K2Cr2O7 + 7H2SO4 = 3ZnSO4 + Cr2(SO4)3 + K2SO4 + 7H2O
K2Cr2+6O7 + H2S–2 + H2SO4 ? S0 + Cr2+3(SO4)3 + K2SO4 + H2O
Cr+6 + 3e ? Cr+3 2 восстановление, окислитель
S–2 – 2e ? S0 3 окисление, восстановитель
K2Cr2O7 + 3H2S + 4H2SO4 = 3S + Cr2(SO4)3 + K2SO4 + 7H2O
K2Cr2+6O7 + H2O2–1 + H2SO4 ? O20 + Cr2+3(SO4)3 + K2SO4 +H2O
Cr+6 + 3e ? Cr+3 2 восстановление, окислитель
2O–1 – 2e ? O20 3 окисление, восстановитель
K2Cr2O7 + 3H2O2 + 4H2SO4 = 3O2 + Cr2(SO4)3 + K2SO4 + 7H2O |
| Слайд №69 |
 |
K2Cr2+6O7 + H2O + H2S–2 ? S0 + Cr+3(OH)3 + KOH
K2Cr2+6O7 + H2O + K2S–2 ? S0 + K3[Cr+3 (OH)6] + KOH
K2Cr2+6O7 + KOH +H2O + (NH4)2S–2 ? S0 + K3[Cr+3(OH)6] + NH3
2Cr+6 + 6e ? 2Cr+3 1 восстановление, окислитель
S–2 – 2e ? S0 3 окисление, восстановитель
2Cr+6 + 6e ? 2Cr+3 1 восстановление, окислитель
S–2 – 2e ? S0 3 окисление, восстановитель
2Cr+6 + 6e ? 2Cr+ 1 восстановление, окислитель
S–2 – 2e ? S0 3 окисление, восстановитель
K2Cr2O7 + H2O + 3H2S = 3S + 2Cr(OH)3 + 2KOH
K2Cr2O7 + 7H2O + 3K2S = 3S + 2K3[Cr(OH)6] + 2KOH
K2Cr2O7 + 4KOH + H2O + 3(NH4)2S = 3S + 2K3[Cr(OH)6] + 6NH3 |
| Слайд №70 |
 |
K2Cr2+6O7 + S0 ? K2S+6O4 + Cr2+3O3
K2Cr2O7 + S = K2SO4 + Cr2O3
K2Cr2+6O7 + С0 ? K2С+4O3 + С+2О + Cr2+3O3
K2Cr2O7 + 2С = K2СO3 + СО + Cr2O3
K2Cr2+6O7 + Al0 ? Cr0 + KAlO2 + Al2+3O3
K2Cr2O7 + 4Al = 2Cr + 2KAlO2 + Al2O3
Cr+6 + 3e ? Cr+3 2 восстановление, окислитель
S0 – 6e ? S+6 1 окисление, восстановитель
Cr+6 + 3e ? Cr+3 3 2 восстановление, окислитель
С0 – 4e ? С+4 4 1 окисление, восстановитель
С0 – 2e ? С+2 2 1
2Cr+6 + 6e ? 2Cr+3 1 восстановление, окислитель
Al0 – 3e ? Al+3 2 окисление, восстановитель |
| Слайд №71 |
 |
Дихромат калия (хромпик) широко применяется как окислитель
органических соединений:
3С2H5OH + K2Cr2O7 + 4H2SO4 CH3– CHO + Cr2(SO4)3 + K2SO4 + 7H2O
3С3H7OH + K2Cr2O7 + 4H2SO4 3CH3– C–CH3 + Cr2(SO4)3 + K2SO4 + 7H2O
?
O |
| Слайд №72 |
 |
Хроматы щелочных металлов плавятся без разложения, а
дихроматы при высокой температуре превращаются в хроматы.
Дихромат аммония разлагается при нагревании:
(NH4)2Cr2O7 Cr2O3 + N2 + 4H2O
180°C |
| Слайд №73 |
<td class='sludes'

