Окислительно-восстановительные реакции
Слайды и текст этой презентации
| Слайд №1 |
 |
Лекция
Тема:
Окислительно-восстановительные реакции |
| Слайд №2 |
 |
Цели:
Обучающие
Повторить и расширить знания учащихся о ОВР. Важнейшие окислители и восстановители. Ознакомить с методом составления уравнений окислительно-восстановительных реакций. (Метод электронного баланс.) Влияние среды на протекание окислительно-восстановительных процессов.
Воспитательные
Создать положительный настрой к обучению и готовность к активной мыслительной деятельности, используя видеоматериалы и метод демонстрационного эксперимента; воспитывать культуру речи и труда.
Развивающие
Развивать у учащихся познавательный интерес к изучению химии, умение анализировать, сравнивать, делать выводы, самостоятельность учащихся. (ОК 3.: Принимать решения в стандартных и нестандартных ситуациях и нести за них ответственность) |
| Слайд №3 |
 |
План лекции
Понятие о ОВР
Важнейшие окислители и восстановители
Классификация ОВР
Метод электронного баланса
Влияние среды на протекание ОВР
|
| Слайд №4 |
 |
Zn + 2HCL ? ZnCl2 + H2
CuSO4 +2NaOH ? Cu(OH)2? + Na2SO4 |
| Слайд №5 |
 |
Окислительно восстановительные реакции (ОВР) — это реакции, протекающие с изменением степени окисления атомов, входящих в состав реагирующих веществ. |
| Слайд №6 |
 |
|
| Слайд №7 |
 |
|
| Слайд №8 |
 |
|
| Слайд №9 |
 |
|
| Слайд №10 |
 |
|
| Слайд №11 |
 |
|
| Слайд №12 |
 |
|
| Слайд №13 |
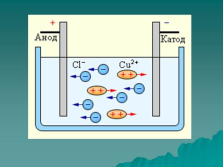 |
|
| Слайд №14 |
 |
Степень окисления.
Элементы с постоянной степенью окисления
Элементы с переменной степенью окисления. |
| Слайд №15 |
 |
Определите степень окисления для магния и алюминия.
Какие степени окисления возможны для серы?
Какие степени окисления возможны для хрома? |
| Слайд №16 |
 |
Опыт натрия с водой |
| Слайд №17 |
 |
-е-
-4, -3, -2, -1, 0, +1, +2, +3, +4, +5, +6, +7, +8
+е- |
| Слайд №18 |
 |
Восстановитель
-элемент, который отдает электроны.
Восстановитель окисляется, повышая свою степень окисления.
Окисление — процесс отдачи электронов |
| Слайд №19 |
 |
Окислитель
элемент, который присоединяет электроны.
Окислитель восстанавливается, понижая свою степень окисления.
Восстановление – процесс принятия электронов |
| Слайд №20 |
 |
|
| Слайд №21 |
 |
Влияние степени окисления на окислительные и восстановительные свойства элементов.
В высшей положительной степени окисления элемент проявляет только окислительные свойства
В промежуточной степени окисления и окислительные и восстановительные свойства.
В высшей отрицательной степени окисления только восстановительные степени окисления.
|
| Слайд №22 |
 |
Классификация окислительно-восстановительных реакций |
| Слайд №23 |
 |
|
| Слайд №24 |
 |
|
| Слайд №25 |
 |
|
| Слайд №26 |
 |
1. Межмолекулярные
Fe + CuSO4 ? Cu + FeSO4
2. Внутримолекулярные
(NH4)2Cr2O7 = Cr2O3 + N2 + 4H2O
3. Самоокисления-самовосстановления (диспропорционирования)
Cl2 + H2O ? HCl + HClO |
| Слайд №27 |
 |
|
| Слайд №28 |
 |
|
| Слайд №29 |
 |
Вывод:
|
| Слайд №30 |
 |
|
| Слайд №31 |
 |
Домашнее задание |
Оцените статью:
(0 голосов, среднее: 0 из 5)
Поделитесь с друзьями!
Большой сборник презентаций в помощь школьнику.
закрыть
Скопируйте этот код и вставьте его на своем сайте:

