Сера и её свойства
Слайды и текст этой презентации
| Слайд №1 |
 |
Сера и её свойства
Презентация составлена к уроку химии в
9 классе |
| Слайд №2 |
 |
Цели урока
Охарактеризовать положение серы в Периодической системе, строение атома, физические и химические свойства серы.
Охарактеризовать природные соединения серы, а также области ее применения.
|
| Слайд №3 |
 |
Визитка химического элемента.
Химический знак — S
Порядковый номер – 16
Аr — 32.066
Период — III
Группа – V I
Подгруппа – главная
Электронная формула атома –1s22s22p63s23p4
Радиус атома – 0.104 нм.
Электроотрицательность – 2.58
S 16
Sulfur 2
32.066 8
3s23p4 6 |
| Слайд №4 |
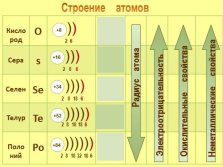 |
Кислород
О
2s22р4
Сера
s
3s23p4
Селен
Se
4s24p4
Телур
Te
5s25p4
Поло
ний
Po
6s26p4
|
| Слайд №5 |
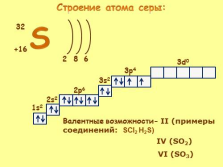 |
S
+16
32
2
6
8
1s2
2s2
2p6
3s2
3p4
3d0
Валентные возможности- II (примеры соединений: SCl2 H2S)
IV (SO2)
VI (SO3)
Строение атома серы: |
| Слайд №6 |
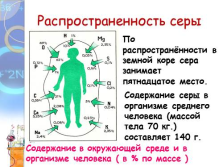 |
Распространенность серы
Содержание в окружающей среде и в организме человека ( в % по массе )
По распространённости в земной коре сера занимает
пятнадцатое место.
Содержание серы в организме среднего человека (массой тела 70 кг.) составляет 140 г. |
| Слайд №7 |
 |
Нахождение серы в природе.
Сера в природе
Самородная сера -S
Сульфиды
Пирит –FeS2
Сульфаты
Гипс-СаSO4*2H2O
Мирабилит –Na2SO4*10H2O
Горькая соль-MgSO4*7H2O
Киноварь HgS
Халькопирит
CuFeS2 |
| Слайд №8 |
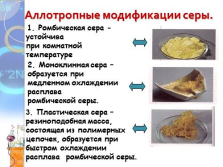 |
Аллотропные модификации серы.
1. Ромбическая сера —
устойчива
при комнатной температуре
2. Моноклинная сера – образуется при
медленном охлаждении расплава
ромбической серы.
3. Пластическая сера –
резиноподобная масса,
состоящая из полимерных
цепочек, образуется при быстром охлаждении
расплава ромбической серы. |
| Слайд №9 |
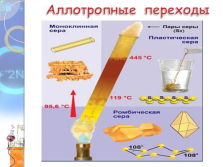 |
Аллотропные переходы |
| Слайд №10 |
 |
Физические свойства.
— твердое агрегатное
состояние
— желтого цвета
— не растворима в воде
— не смачивается водой
(ФЛОТация)
— растворяется в
органических
растворителях |
| Слайд №11 |
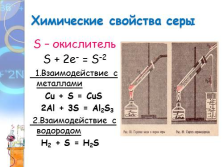 |
Химические свойства серы
S – окислитель
S + 2е- = S-2
1.Взаимодействие с металлами
Сu + S = CuS
2Al + 3S = Al2S3
2.Взаимодействие с водородом
H2 + S = H2S
|
| Слайд №12 |
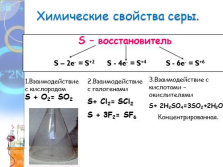 |
Химические свойства серы.
S – восстановитель
S – 2e- = S+2 S — 4e- = S+4 S — 6e- = S+6
1.Взаимодействие с кислородом
S + O2= SO2
2.Взаимодействие с галогенами
S+ Cl2= SCl2
S + 3F2= SF6
3.Взаимодействие с кислотами – окислителями
S+ 2Н2SО4=3SO2+2H2O
Концентрированная.
|
| Слайд №13 |
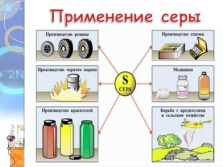 |
Применение серы |
| Слайд №14 |
 |
Кто есть кто на данном
семейном портрете?
Соединения серы |
| Слайд №15 |
 |
Круговорот серы в природе |
| Слайд №16 |
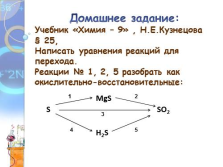 |
MgS
S SO2
H2S
Домашнее задание:
Учебник «Химия – 9» , Н.Е.Кузнецова
§ 25,
Написать уравнения реакций для перехода.
Реакции № 1, 2, 5 разобрать как окислительно-восстановительные:
2
1
4
3
5 |
| Слайд №17 |
 |
Как Вы поняли материал?
Нет, я не понимаю
Я не полностью уверен
Да, я понимаю
А
В
С |
| Слайд №18 |
 |
Использованные материалы и Интернет-ресурсы
Кузнецова Н.Е.Учебник «Химия – 9». М.: Вентана-Граф, 2008
Единая коллекция Цифровых Образовательных Ресурсов
http://school-collection.edu.ru
Виртуальный учебник по химии
http://www.chemistry.ssu.samara.ru/
Каталог образовательных ресурсов по химии
http://www.mec.tgl.ru/index.php?module=subjects&func=viewpage&pageid=149
Я иду на урок химии
http://him.1september.ru/urok/
|
| Слайд №19 |
 |
Презентация на тему: «Сера и её свойства.»
Выполнила
Козлова Оксана Николаевна,
учитель химии
МБОУ «СОШ №8»
г. Ефремов Тульской области
|
Оцените статью:
(1 голос, среднее: 4 из 5)
Поделитесь с друзьями!
Большой сборник презентаций в помощь школьнику.
закрыть
Скопируйте этот код и вставьте его на своем сайте:

